キーワードから探す
カテゴリから探す すべてのカテゴリを見る
原薬・添加剤・中間体
製造機械・装置
物流・輸送
プロセス測定・検査
ラボ用測定・分析
滅菌・クリーン
供給・搬送
プラント・設備
包装関連
受託サービス
バイオ(抗体)医薬品
ITソリューション
コンサルティング・翻訳・その他
WEB展示場に出展中の企業・製品情報
注目の出展製品 すべての製品を見る
WEB展示場 出展企業 すべての企業を見る
【AD】可食性カプセルの常識を変え、 高付加価値製品創出のキーとなる技術が誕生
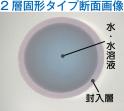
ソフトカプセルのパイオニアである富士カプセルが、これまで困難とされてきた水・水溶液・親水性成分を、安定的に封入できるシームレスカプセルの開発に成功した。可食性カプセルの常識を変える新技術「ウォーター ...続き 2026/01/26
【AD】多様化する再生医療CDMOの製造課題を “デジタル基盤”で解決
2025年11月18〜19日、PDA Cell & Gene Pharmaceutical Products Conference(細胞及び遺伝子医薬討論会/以下、討論会)が東京で開催された。3回目 ...続き 2026/01/28
【AD】mRNA-LNPのスピーディーな開発を支える ワンストップCDMO体制
mRNA-LNP製剤の開発は急速に広がっている。一方で、mRNAの設計からLNP処方探索、治験薬製造、商用スケールまでを一貫して担えるCDMOは多くない。富士フイルム富山化学は、富士フイルムグループ ...続き 2026/02/02
【AD】開発スピード向上へ“データ駆動型の研究開発”へ転換 第一三共、CMC研究におけるDXの基盤にLIMS「LabWare」を導入
第一三共は、中期経営計画の重点テーマとしてDX推進を掲げ、創薬から臨床開発、サプライチェーン、販売・情報提供まで製薬バリューチェーン全体で先進デジタル技術の活用を進めている。その中で、CMC研究機能 ...続き 2026/02/04
最新業界トピック(ニュース記事の閲覧には会員登録【無料】が必要です。)
- 中外、ADC技術に関するライセンス契約 スイス・Araris社と 2026/02/12
- 米国でのベタニス特許侵害訴訟でLupin社と和解、アステラス 2026/02/12
- 製品回収 小野薬品、オプジーボ等を自主回収 工程内検査でバイアル内に製造機器由来の金属異物 2026/02/10
- GEヘルスケアファーマ、埼玉ロジスティクスセンターを開設 国内2つの物流拠点体制へ 2026/02/10
- かきくけこらむ 推しの箱を見つける、推しの箱になる 2026/02/10
- 製造業者等の問題検知力及び問題解決力の向上に関するワークショップ GMP調査員の視点による問題解決に向けた考え方、愛知県での指摘事例も紹介 2026/02/09
- 持田、米国に子会社設立 バイオマテリアル事業のグローバル展開を推進 2026/02/09