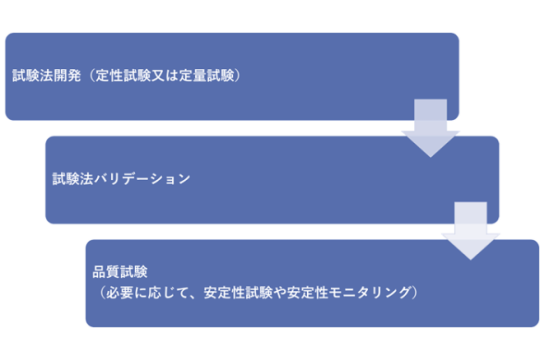
当社では、GMP省令準拠で管理された分析機器を使って、バイオ医薬品や低分子医薬品の試験法開発・バリデーションが実施可能です。
当社の試験法開発・バリデーションの対象試験
ICH-Q14及びICH-Q2に準拠し、主に以下の試験が実施可能です。
・確認試験(IR、XRD、NMR他)
・不純物(純度試験)
-水分
-類縁物質
-残留溶媒試験
-元素不純物試験
-ニトロソアミン類分析
・定量法
-含量/力価(HPLC)
-定量NMR
分析事例は、関連資料をご覧ください。
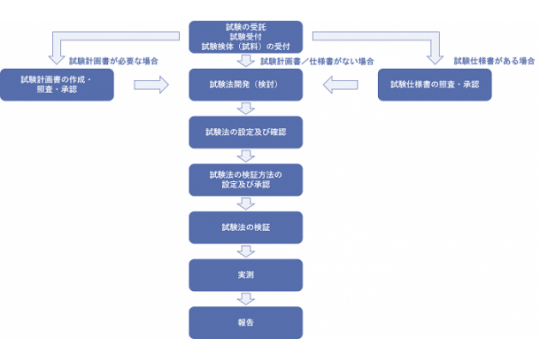
当社の試験法開発・バリデーションのワークフロー
図をご覧ください。
試験受託後、試験計画書を作成する必要がある場合は、当社の品質管理責任者及び品質保証責任者が、発注書や依頼内容等を基に試験計画書を作成し、照査・承認します。
お客様より提供された試験仕様書を試験計画書とする場合は、当社の品質管理責任者及び品質保証責任者が、試験仕様書を照査・承認します。
試験法開発(検討)では、試験受託時に入手した情報を基に、試料溶液の調製法や試験条件等につき、探索的に条件を検討します。
その結果を基に、試験法の設定及び確認を実施します。
試験計画書、試験仕様書又は依頼内容に従って、試験法の検証方法(バリデーションを含む)を設定します。
試験法の検証では、試験法及び検証方法に従って測定を実施します。
実測をご希望される場合は、試験法の検証結果に問題がないことを確認した後に実施します。
これらの結果をまとめ、報告します。
バイオ医薬品/低分子医薬品の品質試験をお考えであれば、ぜひ当社をご活用ください。さらに詳しい情報は、「バイオ医薬品/低分子医薬品の試験法開発・バリデーションについて詳しくみる」をご覧ください。
ご質問やご相談は、お気軽に「公式ホームページのお問い合わせフォーム」又は「この製品へのお問い合わせ」より、お問い合わせください。
- WEB展示場 TOP
- ユーロフィン分析科学研究所株式会社
- バイオ医薬品/低分子医薬品の試験法開発・バリデーション
関連リンク
関連資料
バイオ医薬品/低分子医薬品の試験法開発・バリデーションに関するお問い合わせ
※ご入力の内容は、直接、お問合せ先企業様に通知されます。
※このお問い合わせフォームでの営業・勧誘などはご遠慮ください。
この企業の他の出展商材
-
各種ガイドラインに準拠したCCIT(定性試験及び定量試験)が実施可能
無菌医薬品の容器完全性試験(CCIT)
ユーロフィン分析科学研究所株式会社 -

GMP省令準拠で管理された分析機器を使った品質試験が実施可能
バイオ医薬品/低分子医薬品の品質試験
ユーロフィン分析科学研究所株式会社 -
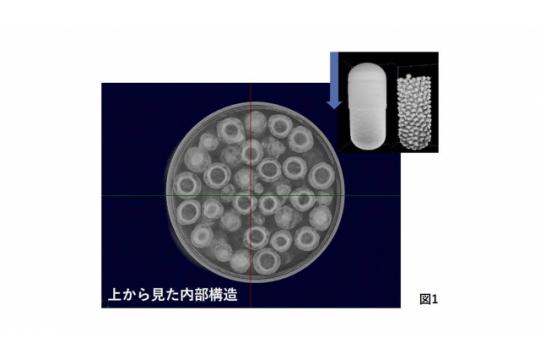
非破壊分析やイメージング解析を用いて、コーティング層や核粒子の成分分析が可能...
医薬品の製剤開発トータルサポート
ユーロフィン分析科学研究所株式会社 -
CT-X線・FT-IR顕微鏡・レーザーラマン顕微鏡による微小異物の同定も可能...
異物分析ー医薬品錠剤や液中に混入した異物を非破壊分析で同定ー
ユーロフィン分析科学研究所株式会社
企業情報
ユーロフィン分析科学研究所株式会社
- 住所京都府京都市下京区中堂寺粟田町93 KRPガスビル 6F
- TEL075-311-2598 / FAX 075-311-2631
- URLhttps://www.eurofins.co.jp/e-asl/