医薬品原薬・製剤の研究開発や製造を行っているメーカーで、ICH-Q3Dガイドラインに基づいた、原料、原薬、中間体、製剤の元素不純物試験を実施したいとお考えではないでしょうか。
当社では、GMP省令準拠で管理された分析機器を用いて、ICH-Q3Dガイドラインに基づいた元素不純物のスクリーニング分析、定量法もしくは限度試験法の試験法開発、バリデーション及び実サンプルの試験が可能です。
国内における新製剤の申請では、2015年9月30日に発出された「医薬品の元素不純物ガイドラインについて」(薬食審査発0930第4号 平成27年9月30日)(ICH-Q3Dガイドライン)に基づいた元素不純物試験が求められています。
また、2021年6月7日に公示施行された「第十八改正日本薬局方(JP18)」においても、ICH-Q3Dガイドラインの内容が盛り込まれ、「日本薬局方の製剤は、原則として一般試験法の元素不純物<2.66>に係る規定に従って適切に管理を行う」とされています。
さらに、「医療用医薬品に係る元素不純物の取扱いについて」(薬生薬審発1228第7号 令和2年12月28 日)において、日本薬局方以外の製剤も、JP18告示施行後36か月までに、JP18を踏まえた元素不純物の管理を行うことが求められています。
その他、ICH-Q3Dの普及に伴い、各局方の重金属試験法がICP等を用いた元素不純物試験に変更されつつあります。
旧来の重金属試験法は、金属を硫化物にして沈殿させ、目視で標準液と比較しPb量としてあらわす限度試験です。この試験法では、個々の金属量を評価することができません。また、その規格値も毒性学に基づいていません。
一方、元素不純物試験では、分析機器を用いて、個々の金属量を定量法もしくは限度試験で評価でき、その規格値は毒性学の観点で設定されるため、より厳密な医薬品の品質管理に適しています。
そのため、最終製品の製剤だけでなく原薬においても、元素不純物試験が規格及び試験方法に盛り込まれることが想定され、新たに試験方法の設定が必要となってきます。
今後、医薬品の安全性確保のためにも、原料、原薬、中間体、製剤等に対する元素不純物試験を適切に実施していくことが必要です。
医薬品における元素不純物ガイドライン(ICH-Q3Dガイドライン)
本ガイドラインでは、ICH-Q9 に記載されているリスクマネジメントの原則を用いて製剤中の元素不純物を評価し、管理するプロセスが示されています。
直近では、2020年において「医薬品の元素不純物ガイドラインの改正について」(薬生薬審発0626第1号 令和2年6月26日)の通達で、以下の点が改正されました。
・カドミウムの吸入暴露時 PDE 値(permitted daily exposure:許容一日曝露量)算出方法の見直しに伴う数値等の修正(付録2及び付録3)
・安全性基準の根拠となった毒性に関する知見の追加(付録3)
これらは、2021年7月1日以降に申請される新医薬品に対し適用されることとなりました。
本ガイドラインは、以下10章で構成されています。
1.はじめに
2.ガイドラインの適用範囲
3.元素不純物の安全性評価
4.元素の分類
5.元素不純物のリスクアセスメント及び管理
6.元素不純物の管理
7.PDE 値と濃度限度値との間の換算
8.スペシエーション及びその他の検討事項
9.分析手順
10.ライフサイクルマネジメント
各章の概要は、以下の通りです。
第1章では、本ガイドラインの趣旨が簡潔に記載されています。
第2章では、本ガイドラインの適用範囲が記載されています。
本ガイドラインは、新製剤(*)及び既存の原薬を含有する新製剤に適用されます。その他、精製されたタンパク質及びポリペプチド、それらの誘導体及びそれらが構成成分である製品を含有する製剤も適用範囲とされています。
*:これまである地域またはメンバーとなっている国で承認されたことがない医薬品製剤(錠剤、カプセル、液状製剤、クリームなど)で、一般に1種の医薬品成分を含む。(ICH-Q6Aにおける定義による)
第3章では、主に、経口製剤、注射剤及び吸入剤に関する元素不純物の安全性評価の原則として、各元素不純物のPDE値の算出方法の概要が記載されています。
また、経口、注射及び吸入の投与経路以外に関してPDE値についても、本ガイドラインの基本的な考え方に基づいた算出方法の概要が記載されています。
第4章では、評価対象となる元素の分類について記載されています。
本ガイドラインに記載されている元素は、毒性(PDE値)及び製剤中に存在する可能性に基づいて3つのクラスに分類されています。
・クラス1:As、Cd、Hg、Pb
・クラス2:(サブクラス2A)Co、Ni、V
(サブクラス2B)Ag、Au、Ir、Os、Pd、Pt、Rh、Ru、Se、Tl
・クラス3:Ba、Cr、Cu、Li、Mo、Sb、Sn
第5章では、元素不純物のリスクアセスメント及び管理について、その一般原則、元素不純物の潜在的な起源、潜在的元素不純物の特定、リスクアセスメントにおいて考慮すべき元素に関する推奨事項、評価、リスクアセスメントプロセスの概要、バイオテクノロジー応用製品で特別に考慮すべきことが記載されています。
第6章では、元素不純物の管理についての趣旨、設定PDE値を超えないことを保証するためのアプローチ例が記載されています。
第7章では、、製剤中又はその構成成分中の元素不純物を評価する際のツールとして有用である、設定 PDE 値(μg/day)から濃度(μg/g)へ換算する方法が記載されています。
第8章では、スペシエーション(同位体組成、電子状態、酸化状態及び/又は複合体もしくは分子構造といった化学種間の元素の分布)及びその他の検討事項が記載されています。
第9章では、元素不純物の測定が意図した目的に適した手順を用いるべきある旨が記載されています。
第10章では、元素不純物とライフサイクルマネジメントとの関連性いついて記載されています。
当社のICH-Q3Dにおける元素不純物試験のアプローチ
当社のICH-Q3Dにおける元素不純物試験の一般的なワークフローは次の通りです。
1.リスクアセスメント
2.評価対象元素のスクリーニング分析
3.試験法開発(定量法もしくは限度試験法)
4.試験法バリデーション
5.実サンプルの試験
まず、お客様に評価対象製品のリスクアセスメントを実施していただきます。
その情報をもとに、評価対象元素(ICH-Q3Dガイドライン記載の24元素や、お客様ご要望の元素)について、スクリーニング分析を実施します。
分析装置としては、誘導結合プラズマ質量分析装置(ICP-MS)を用います。
その結果や管理閾値をもとに、最適な試験法(定量法もしくは限度試験法)を開発・提案します。
ICH-Q2ガイドラインに基づいて、試験法バリデーションを実施します。
バリデートした試験法を用いて、実サンプルの試験を実施します。
元素不純物試験をユーロフィン分析科学研究所に依頼するメリット
1.長年に渡る実績に基づいた、最適な試験法開発・バリデーション・試験実施が可能
2.GMP省令準拠で管理されたICP-MSを用いて、高感度、高信頼度で分析可能
当社は、13年間アステラス製薬株式会社のグループ会社として、多くの医薬品開発を支援してきました。
元素不純物試験では、ICH-Q3Dガイドラインが制定される前から経験があり、またFDA等の当局査察も経験し、適合証明を受領しています。
これらの長年の経験と実績を活用し、お客様のご要望に沿った形で、最適な試験法を開発から試験実施まで可能です。
当社は、GMP省令に準拠した組織を構築しています。その運営下で、プロトコルの作成、試験、サンプルの保管、施設・機器・システムの管理を実施しています。
その管理下にある、以下のICP-MSが利用可能です。
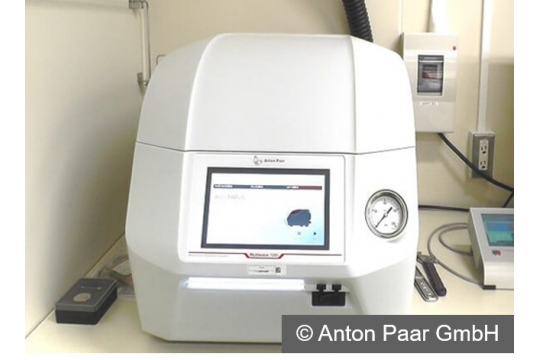
・Agilent 8900 ICP-MS/MS(画像の機器)
・Agilent 7900 ICP-MS
元素不純物試験ではppbレベルといった極微量濃度での管理が求められるため、対象元素を高感度で検出できるICP-MSを用いた分析が有効な手段です。
ICP-MSは、ICP-OES(誘導結合プラズマ発光分析装置)に比べ高感度で、その定量下限はpptレベルです。
また、サンプル溶液中の元素を質量数で分離し検出するため定性分析にも適しています。
さらに当社では、サンプルの前処理で必要となる最新鋭の高圧マイクロウェーブ分解装置(アントンパール社製Multiwave 7000)(画像の機器)も保有しており、数百検体に上る原薬や製剤の分解実績・経験があります。
また、不純物試験では、サンプル調製、分析操作を行う上では使用器具・環境中からの元素不純物の汚染リスクが常に隣り合わせの状況にあり、汚染リスクを低減させた環境が求められます。
当社では、サンプルの汚染リスクを十分に低減させた実験環境で、ICP-MSを用いた分析で、高感度かつ高信頼度の結果を提供しています。
ユーロフィン分析科学研究所では、GMP省令準拠で管理された分析機器を用いて、ICH-Q3Dガイドラインに基づいた元素不純物試験の試験法開発、バリデーション、実サンプルの試験が可能です。
元素不純物試験をお考えであれば、ぜひ当社をご活用ください。
さらに詳しい情報は、「元素不純物試験(ICH-Q3D)について詳しくみる」をご覧ください。
ご質問やご相談は、お気軽に「公式ホームページのお問い合わせフォーム」又は「この製品へのお問い合わせ」より、お問い合わせください。
- WEB展示場 TOP
- ユーロフィン分析科学研究所株式会社
- 元素不純物試験(ICH-Q3D)
関連リンク
元素不純物試験(ICH-Q3D)に関するお問い合わせ
※ご入力の内容は、直接、お問合せ先企業様に通知されます。
※このお問い合わせフォームでの営業・勧誘などはご遠慮ください。
この企業の他の出展商材
-
GMP省令準拠で管理された分析機器を使った試験法開発・バリデーションが実施可...
バイオ医薬品/低分子医薬品の試験法開発・バリデーション
ユーロフィン分析科学研究所株式会社 -

申請用の安定性試験対応、24 時間モニタリング、非常用電源も完備
医薬品の安定性試験・GMP準拠の検体保管サービス
ユーロフィン分析科学研究所株式会社 -
各種ガイドラインに準拠したCCIT(定性試験及び定量試験)が実施可能
無菌医薬品の容器完全性試験(CCIT)
ユーロフィン分析科学研究所株式会社 -
国内で実施できなくてお困りの試験において、海外ラボを通じたソリューションを提...
グローバルサービス(海外ラボ試験委託サポート)
ユーロフィン分析科学研究所株式会社
企業情報
ユーロフィン分析科学研究所株式会社
- 住所京都府京都市下京区中堂寺粟田町93 KRPガスビル 6F
- TEL075-311-2598 / FAX 075-311-2631
- URLhttps://www.eurofins.co.jp/e-asl/