バイオ医薬品、もしくはバイオ後続品(バイオシミラー)を研究開発する製薬企業で、バイオ医薬品の特性解析を行いたいとお考えではないでしょうか。
当社では、GMP省令準拠で管理された分析機器を用いて、バイオ医薬品の特性解析が実施可能です。
バイオ医薬品とは、遺伝子組換え技術や細胞培養技術のバイオテクノロジーを応用して製造した、有効成分がタンパク質である医薬品です。
代表的なバイオ医薬品として、抗体、血液凝固線溶系因子、ホルモン類、インターフェロン類などがあります。
バイオ医薬品は低分子医薬品では十分に解決できなかった疾患への効果が期待され、アンメット・メディカルニーズの解消が期待されています。
また、バイオ後続品とは、国内で既に新有効成分含有医薬品として承認されたバイオテクノロジー応用医薬品(先行バイオ医薬品)と同等/同質の品質、安全性、有効性を有する医薬品として、異なる製造販売業者により開発される医薬品です。
先行バイオ医薬品とバイオ後続品の開発過程は異なりますが、広範かつ詳細な特性解析を行うことが重要な点は同じです。
適切な分析技術を用いた特性解析は、適切な規格及び試験方法を設定するために必要とされています。
規格及び試験方法の掲示は、ICH-Q6B「生物薬品(バイオテクノロジー応用医薬品/生物起源由来医薬品)の規格及び試験方法の設定」(概要は後述)で、承認申請のための必須条件として規定されています。
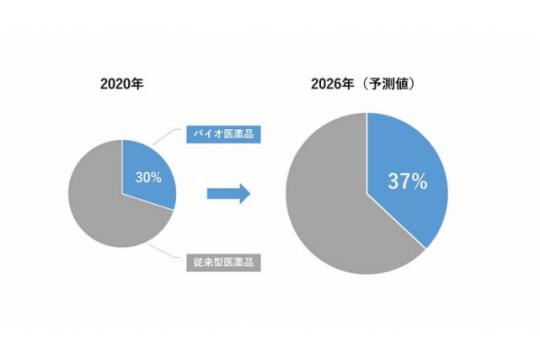
世界のバイオ医薬品市場は、年々拡大しています。
Evaluate Pharma® 「ワールドプレビュー2021 2026年への展望 第14版」の「全世界の処方箋薬・OTC薬売上-バイオ医薬品と従来型医薬品」の調査によると、バイオ医薬品の総売上に占める割合は、2020年では30%であるのに対し、2026年には37%まで上昇することが予測されています。[画像参照]
バイオ医薬品の研究開発はますます活発になってきています。
バイオ医薬品の特性解析のガイドライン
バイオ医薬品の特性解析のガイドラインとして、ICH-Q6B「生物薬品(バイオテクノロジー応用医薬品/生物起源由来医薬品)の規格及び試験方法の設定」(医薬審発第571号 平成13年5月1日)があり、承認申請は本ガイドラインに従うように指示されています。
本ガイドラインは、バイオ医薬品を新たに承認申請し、上市を目指すに当たって、規格及び試験方法の設定並びにその根拠を可能な限り国際的に整合性のあるものとするための一般的な原則について定められています。
本ガイドラインは、以下6章で構成されています。
1.緒言
2.規格及び試験方法の設定において考慮すべき基本的事項
3.規格及び試験方法の設定根拠
4.規格及び試験方法
5.用語集
6.付録
第1章では、本ガイドラインの目的、背景、適用対象がまとめられています。
第2章では、規格及び試験方法の設定において考慮すべき、特性解析、分析上の留意事項、プロセスコントロール、薬局方の規格及び試験方法、出荷規格及び有効期間内規格、統計的な考え方がまとめられています。
バイオ医薬品の特性解析は、適切な規格及び試験方法を設定するために必要となるもので、一般的に以下のような解析項目があります。
1.物理的化学的性質
2.生物活性
3.免疫化学的性質
4.純度、不純物、混入汚染物質
5.物質量
第3章では、規格及び試験方法の設定根拠について、留意すべき点がまとめられています。
規格及び試験方法の試験項目は、採択や除外の根拠及びその妥当性を明確にする必要があるとされています。
また、製造業者は、当該医薬品の同一性、純度及び力価の変化などを総合的に捉えることができる安定性評価指標を定め、提示する必要があるとされています。
第4章では、規格及び試験方法について、原薬や製剤の規格及び試験方法の試験項目例がまとめられています。
第5章では、本ガイドラインで用いられている用語について定義がまとめられています。
第6章では、物理的化学的特性解析の技術的なアプローチ例や、混在する可能性のある不純物例とその由来及び適切な検出方法例がまとめられています。
バイオ医薬品の特性解析の提供サービス
当社では、バイオ医薬品特性解析のガイドラインである、ICH-Q6B「生物薬品(バイオテクノロジー応用医薬品/生物起源由来医薬品)の規格及び試験方法の設定」に基づいた特性解析サービスを提供しています。
解析項目、及び主な分析方法は、以下の通りです。
1.物理化学的性質
末端アミノ酸配列・アミノ酸配列(一次構造):ペプチドマッピング(LC/MS)
翻訳後修飾
・ジスフィルド結合、その他翻訳後修飾:ペプチドマッピング
・フリーチオール解析:Ellman’s assay
・抗体薬物複合体(ADCs)の薬物抗体比 (DAR):HPLC、LC/MS
・PEG化タンパク質:HPLC(CAD)
糖鎖
・糖(中性糖、アミノ糖、シアル酸)定量:HPLC
・糖鎖構造解析:HPLC、CE、LC/MS
・糖鎖結合部位解析:ペプチドマッピング
※海外ラボでは、O型糖鎖構造解析も可能
分子量・分子サイズ
・インタクト及びサブユニット:LC/MS (ESI、APCI)、SEC-UV、SEC-MALS、SDS-PAGE
高次構造
・二次構造、熱安定性、アンフォールディング:円偏光二色性 (遠紫外、近紫外)、FT-IR (ATR・Transmission)
2.生物活性
培養細胞バイオアッセイ(CBA:Cell Based Assay)、生化学的試験
3.免疫化学的性質
ELISA、ウェスタンブロット
4.純度、不純物、混入汚染物質
不純物評価(目的物質由来)
・切断体:HPLC、SDS-PAGE、CE-SDS
・変化体(脱アミド体、チャージバリアント、ジスルフィド結合ミスマッチ体、酸化体、複合タンパク質など):HPLC、cIEF(キャピラリー等電点電気泳動)、ペプチドマッピング(LC/MS)
・凝集体:SEC(UV、RI、MALS)
※海外ラボでは、SV-AUCによる対応可能
不純物評価(製造工程由来)
・宿主細胞由来タンパク質:ELISA、LC/MS
・核酸:PCR
・残留Protein A:ELISA
・界面活性剤(プルロニック、Antifoam等):HPLC(UV、PDA、CAD)
※海外ラボを通じて、ゲルバンド特定(プロテオミクス技術およびデーターベースの活用)も可能
※海外ラボを通じて、フラクションコレクションおよび不明ピークの特定[ペプチドマッピングストラテジー及びNano LC-MS/MS (Thermo Lumos Orbitrap などHigh Resolution Mass spectrometry instrument) ]が可能
混入汚染物質
・微生物:エンドトキシン、バイオバーデン、マイコプラズマ否定試験
・粒子解析:光遮蔽式微粒子測定、PCR・元素分析・ラマン分析等による異物解析等
※海外ラボでは、MFIによる対応可能
5.物質量
タンパク質濃度:紫外可視吸収度測定、SoloVPE
※これら以外についても、お問い合わせください。
バイオ医薬品の特性解析をE-ASLに依頼するメリット
1.バイオ医薬品の特性解析を包括的にサポート
2.バイオ医薬品の試験法開発から品質試験まで一貫して受託可能
3.GMP省令準拠で管理された分析機器を保有
当社では、バイオ医薬品の特性解析について、当社の海外ラボも活用しながら包括的にサポートできます。
当社は、低分子医薬品やバイオ医薬品の試験法開発・品質試験に長年従事しており、これらで培ってきた経験やノウハウを、バイオ医薬品の特性解析にも活用しています。
また、特性解析で得られたデータをもとに、試験法開発から品質試験まで一貫して受託することも可能です。
一例として、以下の試験項目が可能です。
外観・性状
・目視
確認試験
・ペプチドマッピング、質量分析
・SDSポリアクリルアミドゲル電気泳動、等電点電気泳動
・酵素活性、ELISA
・ウェスタンブロット
示性値
・キャピラリー電気泳動
・等電点電気泳動
・単糖分析
・オリゴ糖分析
・グリコフォーム分析
・イオン交換クロマトグラフィー
純度試験
・サイズ排除クロマトグラフィー
・キャピラリー電気泳動
・SDSポリアクリルアミドゲル電気泳動
・ELISA、核酸増幅法
比活法
酵素活性、結合性、細胞応答性
定量法
・液体クロマトグラフィー
・紫外可視吸光度測定法
・酵素活性、結合性、細胞応答性
※これら以外についても、お問い合わせください。
当社は、GMP省令に準拠した組織を構築しています。その運営下で、プロトコルの作成、試験、サンプルの保管、施設・機器・システムの管理を実施しています。
バイオ医薬品の特性解析をお考えであれば、ぜひ当社をご活用ください。さらに詳しい情報は、「バイオ医薬品の特性解析について詳しくみる」をご覧ください。
ご質問やご相談は、お気軽に「公式ホームページのお問い合わせフォーム」又は「この製品へのお問い合わせ」より、お問い合わせください。
- WEB展示場 TOP
- ユーロフィン分析科学研究所株式会社
- バイオ医薬品の特性解析
関連リンク
バイオ医薬品の特性解析に関するお問い合わせ
※ご入力の内容は、直接、お問合せ先企業様に通知されます。
※このお問い合わせフォームでの営業・勧誘などはご遠慮ください。
この企業の他の出展商材
-
2000種を超える物質を掲載した独自ライブラリを用いて成分同定可能
デフォーミュレーションを活用した医薬品の製剤開発サポート
ユーロフィン分析科学研究所株式会社 -
GMP省令準拠で管理されたLC-MS/MSを用いて、高感度・高精度で分析可能...
医薬品中のニトロソアミン類分析の受託試験
ユーロフィン分析科学研究所株式会社 -

ICH-Q3Dガイドライン/JP18に基づいた、原料、原薬、中間体、製剤の元...
元素不純物試験(ICH-Q3D)
ユーロフィン分析科学研究所株式会社 -

お客様専任のチームを編成することで、技術面や生産性を向上させる専門性が高いサ...
FTEプログラム
ユーロフィン分析科学研究所株式会社
企業情報
ユーロフィン分析科学研究所株式会社
- 住所京都府京都市下京区中堂寺粟田町93 KRPガスビル 6F
- TEL075-311-2598 / FAX 075-311-2631
- URLhttps://www.eurofins.co.jp/e-asl/