遺伝子治療用製品等(ウイルスベクター関連)を研究開発・製造・販売する製薬企業で、次のようなことをお考えではないでしょうか。
・in vivo 遺伝子治療用製品に関連する品質試験を実施したい
・in vivo ウイルス治療用製品(腫瘍溶解性ウイルス)に関連する品質試験を実施したい
当社では、GMP省令準拠で管理された分析機器を使って、遺伝子治療用製品等(ウイルスベクター関連)の品質試験が実施可能です。
遺伝子治療用製品等とは、再生医療等製品のうち遺伝子治療用製品、及び遺伝子導入細胞からなるヒト細胞加工製品を言います。
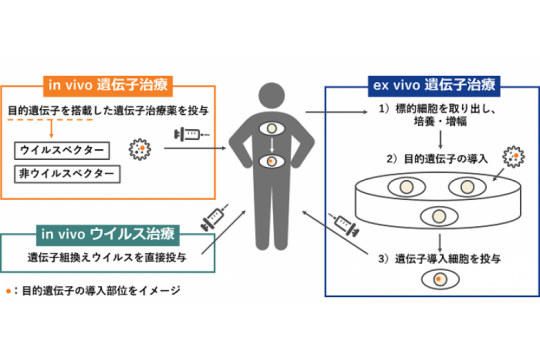
遺伝子治療用製品等の技術は、in vivo 遺伝子治療と、ex vivo 遺伝子治療に大別されます。[画像参照]
in vivo 遺伝子治療とは、目的遺伝子を搭載した遺伝子治療薬を投与する方法です。目的遺伝子の搭載には、ウイルスベクター、非ウイルスベクター(プラスミド単独、又はプラスミドとリポソーム等のキャリアーとの複合体)が利用されています。
この他、ベクターを利用せず、遺伝子組換えウイルスを直接投与する方法(in vivo ウイルス治療)もあります。
一方、ex vivo 遺伝子治療とは、遺伝子導入細胞を投与する方法です。遺伝子導入細胞は、標的細胞を取り出し、培養、増幅し、ベクターによる目的遺伝子を導入することで製造されます。
昨今、これら遺伝子治療製品等の研究開発は、年々活発になって来ています。
また、国内外の市場規模も、年々拡大が予測されています。例えば、in vivo 遺伝子治療では、2020年の1700億円に対し、2025年では1兆326億円、2030年では2兆6374億円と約15.5倍の成長が見込まれています。
これらを踏まえると、今後、さらに遺伝子治療用製品等(ウイルスベクター関連)の研究開発は活発になってくると思われます。
国内におけるウイルスベクター関連のガイドライン
国内においては、ウイルスベクター関連のガイドラインとして、「遺伝子治療用製品等の品質及び安全性の確保に関する指針」(薬生機審発0709第2号 令和元年7月9日)があり、製造販売承認申請にあたって参考とするように指示されています。
本指針では、遺伝子治療用製品等(再生医療等製品のうち遺伝子治療用製品、及び遺伝子導入細胞からなるヒト細胞加工製品)の品質及び安全性の確保のために必要となる基本的な技術的事項について定められています。
本指針は、以下6章で構成されています。
・第1章:総則
・第2章:遺伝子治療用製品等の概要及び開発の経緯等
・第3章:品質
・第4章:非臨床試験
・第5章:治験における留意事項
・第6章:遺伝子治療用製品等の第三者への伝播のリスク等の評価について
第1章では、本指針の目的、適用対象、用語の定義がまとめられています。
第2章では、遺伝子治療用製品等について、明らかにすべき点がまとめられています。
第3章では、遺伝子治療用製品等の構造、特性、製造方法及び品質管理の方法、安定性等についてまとめられています。
第4章では、遺伝子治療用製品等をヒトに投与した際にヒトで予測される薬理学的及び毒性学的な影響に関する試験がまとめられています。
第5章では、治験実施の正当性、治験実施計画、被験者の追跡調査計画等の留意点がまとめられています。
第6章では、「ICH見解:ウイルスとベクターの排出に関する基本的な考え方」を参考に、患者に投与したベクターが、投与を受けた患者以外の第三者へ伝播するリスクを含む、ヒトに与える影響を評価するよう記載されています。
各種ガイドラインの最新版は、厚生労働省又は独立行政法人 医薬品医療機器総合機構(PMDA)のHPにてご確認ください。
ウイルスベクター関連品質試験の提供サービス
当社では、ウイルスベクター関連のガイドラインである、「遺伝子治療用製品等の品質及び安全性の確保に関する指針」の「第3章 品質 4.特性解析並びに規格及び試験方法」に基づいた品質試験サービスを提供しています。
対象試料は、in vivo 遺伝子治療用製品やin vivo ウイルス治療用製品等です。
カテゴリー別の試験項目は、以下の通りです。
外観・性状
・外観・性状
一般試験
・pH
・浸透圧
・採取容量 ・不溶性微粒子
・不溶性異物
確認試験
・ウイルスゲノム
純度試験
・プラスミド由来DNA
・宿主由来DNA
・宿主由来タンパク質
・ヘルパーウイルス
・各種残留酵素
・カプシド率
・その他工程由来不純物
感染性因子
・微生物限度試験
・無菌試験
・マイコプラズマ否定試験
・ウイルス試験
・増殖性ウイルス試験
・エンドトキシン試験
生物活性又は力価
・生物活性試験
・感染力価試験
含量
・ウイルス粒子数
・ウイルス力価
その他
・粒子径分布
・凝集体
ウイルスベクター関連品質試験をE-ASLに依頼するメリット
1.ウイルスベクター関連品質試験を包括的にサポート
2.バイオセーフティ室(BSL-2 /P2対応)を完備し、幅広いウイルスベクター種に対応可能
3.GMP省令準拠で管理された分析機器を保有
当社では、ウイルスベクター関連の品質試験項目について、当社の海外ラボも活用しながら包括的にサポートできます。
低分子医薬品やバイオ医薬品の試験法開発・品質試験に長年従事しており、これらで培ってきた経験やノウハウを、ウイルスベクター関連にも活用しています。
また、BSL-2/P2に対応したバイオセーフティ室を完備しています。これにより、BSL-1で取り扱い可能なアデノ随伴ウイルス(AAV)だけではなく、BSL-2で取り扱い可能なアデノウイルス、レトロウイルス、ワクシニアウイルス、レンチウイルス、単純ヘルペスウイルス、センダイウイルス等、幅広いウイルスベクター種に対応可能です。
当社は、GMP省令に準拠した組織を構築しています。その運営下で、プロトコルの作成、試験、サンプルの保管、施設・機器・システムの管理を実施しています。
例えば、Bio-Rad社のDroplet Digital PCRシステム(ddPCR)や、サーモフィッシャー社のリアルタイムPCRシステム(qPCR:定量PCR)を保有しています。(画像)
ウイルスベクター関連品質試験をお考えであれば、ぜひ当社をご活用ください。さらに詳しい情報は、「ウイルスベクター関連品質試験について詳しくみる」をご覧ください。
ご質問やご相談は、お気軽に「公式ホームページのお問い合わせフォーム」又は「この製品へのお問い合わせ」より、お問い合わせください。
- WEB展示場 TOP
- ユーロフィン分析科学研究所株式会社
- 遺伝子治療用製品等(ウイルスベクター関連)の品質試験
関連リンク
遺伝子治療用製品等(ウイルスベクター関連)の品質試験に関するお問い合わせ
※ご入力の内容は、直接、お問合せ先企業様に通知されます。
※このお問い合わせフォームでの営業・勧誘などはご遠慮ください。
この企業の他の出展商材
企業情報
ユーロフィン分析科学研究所株式会社
- 住所京都府京都市下京区中堂寺粟田町93 KRPガスビル 6F
- TEL075-311-2598 / FAX 075-311-2631
- URLhttps://www.eurofins.co.jp/e-asl/