バイオ医薬品や再生医療等製品の研究開発や製造を行っているメーカーで、次のようなことをお考えではないでしょうか。
・国内での上市予定の製品に対して、日本薬局方(JP)に準拠したマイコプラズマ否定試験を迅速に実施したい
・米国や欧州での上市予定の製品に対して、各ガイドラインに準拠したマイコプラズマ否定試験を迅速に実施したい
・医薬品製造、又は細胞培養の工程内でマイコプラズマ否定試験を実施したい
当社では、GMP省令準拠で管理された分析機器を用いて、マイコプラズマ否定試験のバリデーションから、実測定、技術移転までトータルで実施可能です。
近年、バイオ医薬品や再生医療等製品の研究開発が増加傾向にあります。これらバイオテクノロジー応用医薬品/生物起源由来医薬品に対し、各国の規制当局はマイコプラズマ否定試験の実施を要求しています。
マイコプラズマは非常に微小な微生物であるため、これら医薬品の製造過程において不純物除去フィルターを通過し、医薬品に混入するリスクがあります。そのリスクを避けるため、マイコプラズマ否定試験による安全性の確認が必要とされています。
マイコプラズマ否定試験の概要
第十七改正日本薬局方 参考情報「バイオテクノロジー応用医薬品/生物起源由来医薬品の製造に用いる細胞基材に対するマイコプラズマ否定試験」では、次の3つの試験方法が挙げられています。
A.培養法
B.指標細胞を用いたDNA染色法
C.核酸増幅法(Nucleic acid amplification: NAT)
対象検体は、マスター・セル・バンク、ワーキング・セル・バンク、医薬品製造工程中の培養細胞です。これらに対して、A法又はB法を実施します。ただし、適切なバリデーションを実施することで、C法を代替法として利用できます。
A法は、一定期間の培養後、顕微鏡でマイコプラズマの集落の有無を調べる方法です。
B法も、一定期間の培養後、染色剤によりDNA蛍光染色し、蛍光顕微鏡でマイコプラズマの存在を確認する方法です。
C法は、検体から抽出した核酸をマイコプラズマに特異的なプライマーやプローブを用いて増幅し、マイコプラズマに由来する核酸の存在の有無を高感度に検出できる方法です。
A法とB法は、試験期間が数日~数十日間と長いことが課題です。
市場で需要の高いバイオ医薬品を早期にリリースしたくても、この試験期間を短縮することはできません。また、製造現場において実施される、マイコプラズマ汚染の検知や封じ込めを目的とした中間体の工程内スクリーニング試験の大きな足かせになります。
そのため、迅速に結果が得られるC法(NAT)が主流になりつつあります。当社ではこの手法を提供しています。
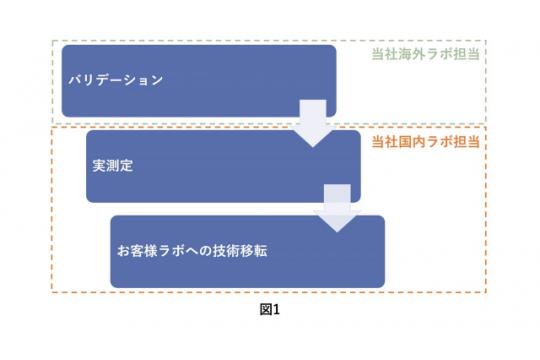
当社でのマイコプラズマ否定試験(C法:NAT)のワークフローを紹介します。(図1)
1.バリデーション
2.実測定
3.お客様ラボへの技術移転
お客様から検体を提供していただき、各国のガイドラインやお客様の検体に合わせ、特異性、検出感度、頑健性など必要なバリデーションを実施します。また、実測定の陽性対照とするマイコプラズマ(生菌)とコントロールDNAの相関データも取得します。
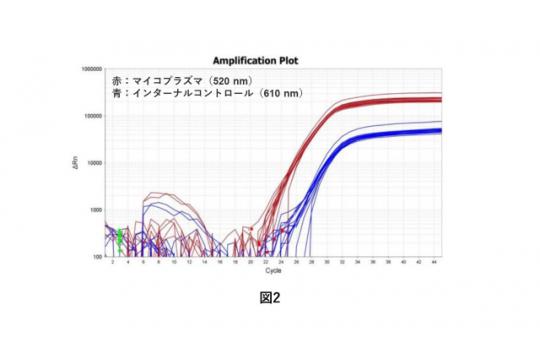
測定には、主にミネルバ・バイオラブス社「Venor®GEM qEPマイコプラズマ検出キット」を用いた定量リアルタイムPCR(qPCR)を使用します。当キットは、マイコプラズマの16S rRNA翻訳領域を増幅し、測定波長520 nm(FAMチャンネル用)で特異的に検出されます。同時に、検体にはインターナルコントロールが添加されており、PCR反応を阻害する物質が含まれているか否かの検証も行われます。 当キットは、第十七改正日本薬局方マイコプラズマ否定試験に準拠、欧州薬局方EP2.6.7に登録されている全てのマイコプラズマを一度に検出できます。
試料調製や操作も簡便で、おおよそ4.5~6.5時間で結果が得られます。
実測定では、バリデートされた試験方法で、生菌を使用せずコントロールDNAを陽性対照として測定します。(図2)
技術移転では、お客様のラボや製造現場においてスムーズに測定をできるようにサポートします。
お客様の研究開発の規模や必要性に応じて、下記の3通りで、マイコプラズマ否定試験サービスを利用できます。
・バリデーション+実測定
・バリデーション+実測定+技術移転
・バリデーション+技術移転
例えば、10回未満の製造の臨床研究や小規模な臨床試験で利用する場合、「バリデーション+実測定」のご依頼、医薬品のリリースまで十分に時間があり、試験は社内で実施したい場合は「バリデーション+技術移転」のご依頼とアレンジできます。
ユーロフィン分析科学研究所に依頼するメリット
1.ユーロフィンBPTネットワークとして、マイコプラズマ否定試験に20年以上の実績
2.技術移転後に生菌を使用しない手法で、低リスク・低コストで試験実施可能
3.フィジビリティスタディ(Feasibility Study)のみのご依頼も可能
4.GMP 省令準拠で管理された分析機器を保有
ユーロフィン BioPharma Product Testing (ユーロフィンBPT)ネットワークでは、培養法を含め長年マイコプラズマ否定試験に力を入れており、海外での規制当局への承認実績、及びノウハウの蓄積といった強みがあります。当社では、これらのノウハウを活用してマイコプラズマ否定試験を組み立て、最適な試験デザインを提案します。
当社では、試験法のバリデーションおいて、マイコプラズマ生菌とコントロールDNAの相関データを取得し、お客様に提供します。
お客様のラボや製造現場において、マイコプラズマ生菌を使用する場合、細胞へのコンタミネーションを回避する対応が必要です。一方、コントロールDNAを用いた試験では、それらの対応は不要となります。
そのため、技術移転後、お客様のラボや製造現場では、生菌を使用せず低リスク・低コストでマイコプラズマ否定試験を実施可能であるというメリットがあります。
当社では、バリデーションの前段階である「フィジビリティスタディ」のみのご依頼も受託可能です。お客様のサンプルで、問題なくマイコプラズマ否定試験が実施できるかどうかを検証することができます。
サンプルによっては、その特性や夾雑物によって、測定できない可能性があります。これらを開発初期段階で調査することで、製造方法などの改善に役立てることができます。
当社では、GMP省令準拠で管理された分析機器を使って、JP、EP、USPなど各国ガイドラインに準拠した、マイコプラズマ否定試験のバリデーションから、実測定、技術移転までトータルで実施可能です。
マイコプラズマ否定試験をお考えであれば、ぜひ当社をご活用ください。さらに詳しい情報は、「マイコプラズマ否定試験について詳しくみる」をご覧ください。
ご質問やご相談は、お気軽に「公式ホームページのお問い合わせフォーム」又は「この製品へのお問い合わせ」より、お問い合わせください。
- WEB展示場 TOP
- ユーロフィン分析科学研究所株式会社
- PCR法を用いたマイコプラズマ否定試験
関連リンク
関連資料
PCR法を用いたマイコプラズマ否定試験に関するお問い合わせ
※ご入力の内容は、直接、お問合せ先企業様に通知されます。
※このお問い合わせフォームでの営業・勧誘などはご遠慮ください。
この企業の他の出展商材
-

低分子医薬品及びバイオ医薬品を製造する製薬企業や、受託製造企業(CDMO/C...
医薬品の工程内試験・出荷試験・安定性モニタリング
ユーロフィン分析科学研究所株式会社 -
GMP省令準拠で管理された分析機器を使った試験法開発・バリデーションが実施可...
バイオ医薬品/低分子医薬品の試験法開発・バリデーション
ユーロフィン分析科学研究所株式会社 -

GMP省令準拠で管理された分析機器を使った品質試験が実施可能
バイオ医薬品/低分子医薬品の品質試験
ユーロフィン分析科学研究所株式会社 -
CT-X線・FT-IR顕微鏡・レーザーラマン顕微鏡による微小異物の同定も可能...
異物分析ー医薬品錠剤や液中に混入した異物を非破壊分析で同定ー
ユーロフィン分析科学研究所株式会社
企業情報
ユーロフィン分析科学研究所株式会社
- 住所京都府京都市下京区中堂寺粟田町93 KRPガスビル 6F
- TEL075-311-2598 / FAX 075-311-2631
- URLhttps://www.eurofins.co.jp/e-asl/