─AD─
開発初期~商業生産まで医薬品ライフサイクル全体の包括的ソリューションを提供
真のグローバル企業が実現・提案するCDMOビジネスを探る
PCI Pharma Services
CDMOとして50年以上の実績と経験をもつPCI Pharma Services(以下、PCI社)。長年培ってきた技術力を武器に、開発初期段階から商業生産、包装に至るまでの包括的なソリューションを提供し続けている。そのPCI社が2025年7月9~11日まで東京ビッグサイトで開催されたインターフェックスジャパンに出展し、サービスの充実ぶりを披露するのに合わせて来日した製剤開発/製造サービス部門EMEA & APACシニアディレクターのJerome Detreille氏、臨床試験サービス部門APACヘッドのTina Leung氏、日本担当の徳田昌彦氏(製剤開発/製造サービス部門)およびTony Kao氏(臨床試験サービス部門)に同社の強みや今後のビジネス展開について話を聞いた。

■PCI社とその事業活動の概要について教えてください
Tina氏|PCI社は、医薬品開発、製造、包装のための統合されたエンドツーエンドのソリューションをお客様に提供し、製品の上市を加速させ、商業的成功の可能性を高めるグローバルCDMOです。年間90件以上の製品上市を成功させてきた実績と、50年以上にわたってCDMOサービスを提供してきた経験を有しています。
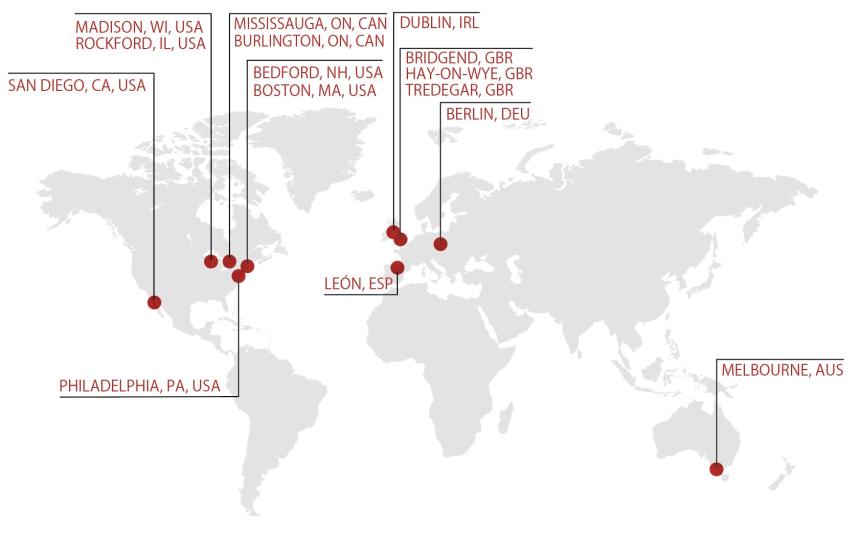
現在、7カ国(オーストラリア、カナダ、米国、アイルランド、英国、ドイツ、スペイン)に38の拠点を有し(図1)、7,500人以上の従業員が高品質な治療薬をお届けするために尽力しています。最先端のテクノロジーと継続的な投資により、製造から臨床試験、商業化、そしてその後の製品ライフサイクル全体を通じて、グローバルな医薬品開発のニーズに応えることができます。PCI社のお客様は、当社を単なる外注先としてではなく、患者様に“Life Changing Therapy”をお届けするためのパートナーであると位置づけていただけていると自負しています。
■CDMOとしてのPCI社の強みを教えてください
Jerome氏|医薬品ライフサイクル全体にわたり、開発初期段階から製品発売、商業化、そして市場への日常供給に至るまで、医薬品開発、製造、包装に関する包括的なソリューションを提供するグローバルCDMOであることが強みです。PCI社は、世界的な品質および薬事規制に関する実績があります。また、人材、施設、技術への継続的な投資を行っています。具体的には、過去10年間で世界的な包装拠点の拡大と製造能力の強化を目的として、数々の戦略的買収と投資を行ってきました。その1つが2014年のPenn Pharmaceutical Servicesの買収です。この買収により、高生理活性医薬品を安全・高効率で生産できるコンテインメント製造施設が取得できたことから、抗がん剤市場に特化した生産能力が確保されました。
また2021年にはLyophilization Services of New England(LSNE)、2025年にはAjinomoto Altheaを買収しました(図2)。これらの戦略的投資により、無菌充填・仕上げ(SFF)および凍結乾燥能力が加わり、特殊製造におけるグローバルな専門知識がさらに拡大しました。Ajinomoto Altheaの買収は、北米におけるSFF能力の大幅な拡大を意味し、バイアル、プレフィルドシリンジ、カートリッジを含む無菌注射剤の臨床および商業供給において確固たる実績をもたらします。Ajinomoto Altheaを当社のネットワークに統合することで、生産能力が大幅に向上し、技術基盤が拡大し、複雑な生物製剤製造のための完全隔離型無菌充填ラインなどの重要な機能が追加されました。
さらに2024年には、プレフィルドシリンジ、オートインジェクター、ペン型デバイス、ウェアラブルインジェクターなど幅広い医薬品・医療機器複合製品の最終組立、ラベリング、包装を行う専用のグローバルインフラの構築に3億6,500万ドルを投資し、早期臨床段階から世界市場への上市までシームレスな開発をサポートできる体制を整えました。

■PCI社の日本における事業展開の概要について教えてください
Tony氏|欧州、英国、北米にあるPCI社の施設は、医薬品医療機器総合機構(PMDA)の承認を受けています。また、医薬品開発、製造、臨床試験、商業用包装の各事業分野において、多くの日本の大手バイオ医薬品企業とも提携しています。なお、2025年7月30日にはレギュレーションに関するネットワーキングイベントを東京で開催するなど活発な活動を展開しています。
■今後、どのような投資や事業強化を計画していますか?
Jerome氏|PCI社は既存の医薬品開発能力を強化するため、1,000万ドル以上を投資しています。具体的には、ニューハンプシャー州ベッドフォードとスペイン・レオンの無菌充填・仕上げ施設の既存スペースを専用の医薬品開発センター・オブ・エクセレンス(CoE)に転換します。これらの専用センターは、段階に応じた製剤、分析、プロセス開発サービスを提供し、バイオ医薬品や複雑な製剤に重点を置いた、モダリティにとらわれない科学主導のアプローチをお客様に提供します。また、スペイン・レオンのSFF施設では、シリンジ、カートリッジ、Ready to Use(RTU)バイアルなどの充填用に2つの新ラインを追加します。
Tina氏|グローバルネットワーク全体で、医薬品製造、臨床試験サービス、高度な医薬品送達/医薬品・医療機器複合製品包装ソリューションをサポートするため、常温、冷蔵、冷凍の保管・配送能力とキャパシティの増強に投資しています。また、デジタルトランスフォーメーション(DX)にも取り組んでいます。具体的には“Right-First-Time”品質へのコミットメントを掲げDXを推進しています。2025年にはMasterControl社と提携し、デジタル品質管理システム(QMS)を立ち上げ、コンプライアンスとインサイトのための統合プラットフォームを構築、さらに電子バッチ記録(eBR)の早期導入と、Labware社とのグローバルな検査情報管理システム(LIMS)の展開を進めています。
サプライチェーンマネジメントにおいては、Pharma 4.0に向けたデジタルロードマップを策定し、継続的な投資とコミットメントを推進しています。一例として、当社のデジタルサプライチェーンプラットフォームである「pci | bridgeTM」をさらに発展させ、製品ロットリリースの可視性の拡張、需要計画および予測ツールの強化、電子フォームなどもご提供できるようになりました。これらの戦略的投資は、いかにして品質、透明性、そして必要な情報をお客様にお届けできるのか、その方法を変革しています。
■今後の日本での事業計画についてお聞かせください
徳田氏|私たちは、医薬品の製造および包装のあらゆる面において、品質、精度、信頼性の重要性を認識しており、日本が患者様の安全とイノベーションに強くコミットしていることも理解しています。GMP準拠施設のグローバルネットワークと、固形製剤(OSD)、注射剤、生物学的製剤、そして先進的薬物送達システムに関する深い専門知識を有するPCI社はお客様のニーズに合わせた拡張性、柔軟性、そしてコンプライアンス遵守に配慮したサービスをご提供できる体制を整えています。私たちは今後も日本のパートナーの皆様に、あらゆる剤形および包装形態において、開発初期段階から商業化に至るまで、信頼できるソリューションを提供し続けることをお約束いたします。
長年培ってきた技術力および積極的な投資による設備拡充・生産能力アップを武器にさまざまなエンドツーエンドサービスを提案するPCI社の動向から目が離せない状況が続くと言えるであろう。
■お問い合わせ
PCI Pharma Services
E-mail:talkfuture@pci.com
URL:https://ja.pci.com/
お問い合わせはこちら








