─AD─
~AI駆動型創薬の壁を乗り越える~
標的の発見から臨床応用までの一貫したデータ活用と意思決定をサポート
CAS
10月2日、都内でCAS Life Sciences Summit2025が開催された。米国化学会を母体とするCASは化学物質に関する独自のデータベースや検索プラットフォームを提供し、科学の進展をサポートしてきた。本サミットでは、製薬企業を中心に国内で創薬にかかわるキーパーソンが招かれ、近年発展が目覚ましいAIおよびCASが提供するデータベース・探索ツールCAS BioFinder Discovery Platform™の創薬への活用について、講演やパネルディスカッションで議論が交わされた。本稿では、サミットの模様について紹介する。

■データのジレンマを乗り越えるTriangle for Success
CASは、膨大で複雑な科学データを集約して精選した知識として世界中の研究者や企業に提供し、テクノロジーの進化とともに、CAS SciFinder®やCAS STNext®など、科学の発見を支えるプラットフォームを開発してきた。CASでPresidentを務めるManuel Guzman氏はサミットの冒頭に、2024年にリリースしたCAS BioFinder Discovery Platform™(以下、BioFinder)は、これまでの同社の経験、知見をもとに、化学と生物学を横断するデータを統合し、AIを活用して創薬やバイオ研究における知見探索を加速し、より迅速かつ的確に発見へ到達できるよう支援するツールであると紹介した。
続いて、CASのChief Product OfficerであるTim Wahlberg氏は、CASがAI技術を活用して科学的イノベーションを推進する取り組みを紹介した。Tim氏は、AI活用が進む一方で多くの企業が成果を得られていない背景には「データのジレンマ」があると指摘。科学情報は爆発的に増加しているが、偏りや断片化、形式の不統一がAI学習の妨げとなり、再現性を損ねているという(図1)。
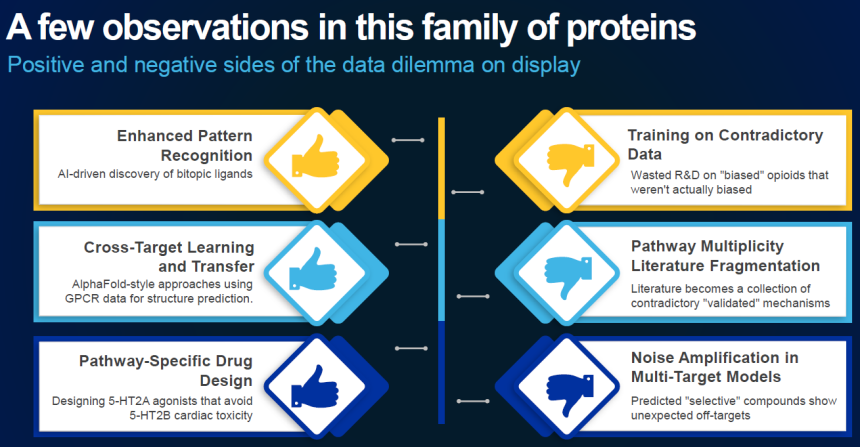
Tim氏は、創薬分野において受容体のわずかな構造の差をクロスターゲット学習することにより、治療効率を高めることが可能になる一方で、矛盾するデータによる学習が精度の低下を招く例も多いという問題点を挙げた。CASはこれに対し、専門家が精査・統合した高品質データを基盤にAIを訓練する「Science smart AI」を推進。さらに、ナレッジグラフと大規模言語モデル(LLM)を組み合わせ、科学的根拠にもとづく推論や検索を実現する仕組みを開発中であるとし、創薬研究者、データサイエンティスト、データ管理の3領域の専門家の連携、‟Triangle for Success”によって、AI駆動型創薬を実現させるとした(図2)。

■創薬のための統合プラットフォームBioFinder
CASのSenior Director of Life Sciences and MaterialsであるAdam R. Sanford氏は、創薬研究支援のために開発されたBioFinderの概要と最新機能を紹介した。BioFinderは、主に前臨床研究を対象に、医薬品開発のプロセスを支援する高度な統合コンテンツプラットフォームである(図3)。データベースは逐次更新されていき、低分子化合物から抗体薬物複合体(ADC)、PROTACなどの抗体ベースの医薬品まで幅広いモダリティをカバーし、安全性、毒性のほかトランスレーショナルサイエンス、オミクスデータも統合予定である。膨大な科学文献、特許、規制情報、バイオマーカー情報、ゲノム・プロテオーム・メタボロームデータを正規化・統合・重複排除し、一貫性のあるデータ構造を構築している。これにより、化合物、パスウェイ、疾病、ターゲット間の複雑な相互関係を追跡可能であり、薬物–標的関係や薬理作用、毒性リスク評価に直結する情報を得られる。

低分子薬では、構造活性相関(SAR)などを通じて、微細な化学構造変更が標的活性に与える影響を可視化できる。ADCやPROTACでは、抗体–薬物結合部位や分解経路、作用する標的タンパク質の生物学的経路との関連を精緻に解析可能である。さらに、AIベースの予測分析により、既存データの空白を埋め、潜在的オフターゲットや未報告の薬理学的作用を推定できる。ユーザーは、特定のタンパク質や反応経路に関する情報を取得でき、関連データを包括的に把握しながら、カスタマイズされた調査レポートを生成することができる。
「BioFinderは、情報源のトレーサビリティも確保しており、各データの出所や信頼性を検証可能である。将来的には、オミクス領域や代謝経路情報の統合をさらに進め、生成AI技術を活用して新規標的や未知の薬理関係を迅速に特定可能にする」とAdam R. Sanford氏は今後の展開を述べた。
■AI創薬の現在地と未来
ノバルティスの茂木宗人氏は、AIが創薬分野に与える影響と現状について解説した。R&DにおけるAI活用に対する満足度には期待と現実のギャップが存在するが、研究者を支援するツールとしての有用性は高いと述べた。ノバルティスでは、AIに対する期待を2つ掲げている。1つは長期的なイノベーションであり、人間が発想しにくい新しいアイデアの創出を支援することである。もう1つは短期的な生産性向上であり、意思決定や分子設計の加速、予測精度を高めることによる創薬の成功確率向上を意味する。
同社の創薬はがん領域、免疫疾患領域、循環器領域、中枢神経領域を中核に、加齢性疾患や再生医療、マラリアやデング熱などのグローバルヘルスにも注力している。モダリティ面では、低分子やバイオ医薬品、siRNA、放射性リガンド療法、遺伝子細胞治療など幅広く研究開発を行っている。AIと生成化学の活用が加速しており、仮想的な分子生成から優先順位付け、合成予測、試験、分析までのDMTAサイクルをデジタルワークフローとして実装している。
AIによる生成モデルは数百万の分子を生成し、予測モデルと3Dドッキングを通じて選別し、最終的に50程度の分子を合成候補として抽出する。複数パラメーターの同時最適化や並行化によって、従来よりも迅速かつ効率的な創薬が可能となっている。ここで課題となるのが、ポジティブデータだけでなく、失敗した反応などのネガティブデータも活用することが、予測モデルの精度向上に寄与する点を指摘し、データセットの重要性を強調した。
茂木氏は、AIが創薬に与える影響について具体的に考えるために、17年前の研究でPNH治療薬の開発過程を紹介した。この治療薬の開発では、FactorBを標的に、候補分子を設計・最適化し、効力、溶解性、CYP3A4の影響を調整した。最終的に、選択性・物理化学的性質に優れた分子を得て、前臨床・臨床試験で期待通りの効果を確認し、2023年にFDA承認を取得した。仮に17年前、ここでAIが活用可能であれば、ターゲット選択やヒット検出の効率化、分子設計の迅速化により、「開発プロセスを大幅に短縮できたであろう」とした。
茂木氏は、今後のAIの展開として構造予測ツールははるかに洗練され、生成化学に利用できる高度なツールがますます増えるであろうと予測した。また、AI実装の課題は技術面だけでなく、研究者自身がAIに適応することであると指摘した。サイロの打破、デジタルワークフローの導入、ネガティブデータの活用、影響測定の重要性を強調し、AIの進化により創薬が強化されることに期待を示した。
■お問い合わせ
CAS
URL:https://www.cas.org/ja
E-mail:ynakagawa@acs-i.org








