─AD─
ALCOA+ に則ったDI 対応ソリューション
様々な製造機器に対応した医薬品製造の高度な監査証跡を実現
第一実業

医薬品製造に求められるデータインテグリティ(DI)対応では、網羅性が重要である。各種ガイドラインにおいて、手書きでのデータ管理は否定されてはいないが、ALCOA +の要求事項を満たすためには電子化が確実な方法である。
しかし、現実には製造機器ごとにDI 対応レベルが統一されず、手書きによる記録を維持したままDI 対応を進める製薬企業も多くみられ、国際競争力の低下が懸念される。こうした状況を打破するソリューションを第一実業が開発した。総合機械商社だからこそ実現できた医薬品製造の監査証跡をデジタルで確実に実現する「FIDIUS」について、同社のヘルスケア事業本部第二営業部長の武内正隆氏に開発経緯や特長について話を聞いた。
■手書きデータ管理の課題 単純な電子化でも対応できないDI
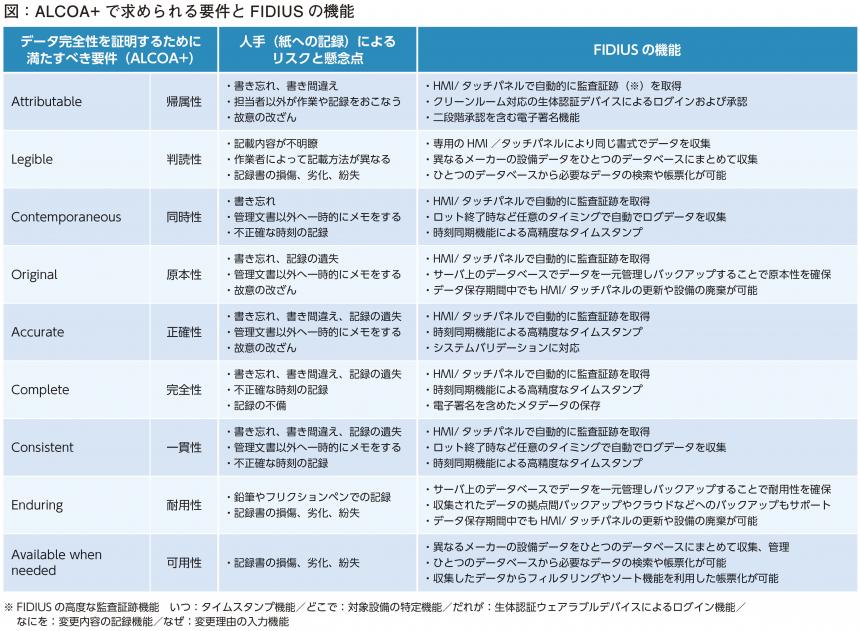
GMP 省令第8条第2項では「手順書等並びにこの章に規定する記録について、その信頼性を継続的に確保する」ことが求められ、日本においても正式にDIが要件化された。また、GMP 事例集2022 年版GMP8-18 では、DI に関する要件として知られているALCOA +(図)に示される機能には、「監査証跡機能」、「データの上書きおよび改ざんを防止する機能」、「ユーザーごとに操作権限を設定する機能」などが挙げられている。
「ALCOA+ の中でも特に重要な帰属性、同時性、完全性、可用性を中心に、手書き(紙の記録書)によるDI 対応での懸念点があり、大手の製薬企業においても手書きでのデータ管理工程が残っているところは少なくない。紙によるアナログ管理では書き忘れ、書き間違い、遺失などのリスクが避けられない。とりあえずメモを取り、後から正式な記録を残そうとする人もいるが、これでは同時性や完全性が満たされない。GMP 教育を徹底し改善を試みてもなお、各社で問題が起こっている。現実的な解決策として、確実に生産ライン全体の監査証跡を残すシステムが求められている」と武内氏は指摘する。
しかし、ここでさらなる問題に突き当たる。DI 対応には網羅性が欠かせないが、各製造機器で監査証跡の項目が異なっていれば、そこに漏れが生じる。各製造ラインで統一されたシステムが必要になるが、その前提となるユーザーセキュリティが担保されなければ、監査証跡自体の信頼性が失われてしまう。データを電子化しても、必ずしもDI 問題は解決されないのだ。
工場全体の監査証跡とそのデータ集積を1 つのプラットフォームで行うことができるようにすることで、これらの問題点を解決できるのがDI/DX ソリューション「FIDIUS」だ。
■一貫した監査証跡とユーザーセキュリティの確保を実現
FIDIUS の基盤となるのは、COPA-DATA 社が提供する生産の可視化、デジタル化を実現するIIoT プラットフォーム「zenon」である。ここに、様々な製造機器に容易に搭載可能なタッチパネル「DI 対応MONITOUCH モニタッチ(発紘電機)」、ユーザーセキュリティを向上させる非接触(リストバンド)型生体認証ウェアラブルデバイス(販売:興和オプトロニクス)などをパッケージ化し、データとユーザーの一元管理、操作性とセキュリティの向上、zenon との接続性向上を実現した。
zenon は、監査証跡機能を有したPC ベースの専用HMIをラインナップしており、製造機器にこの専用HMI を搭載することで監査証跡(操作履歴)に対応しているが、国内の医薬品製造機器メーカーにはPC ベースのHMI 搭載をためらうところも多い。そこで、より搭載障壁の低い汎用タッチパネルMONITOUCH をベースに、ALCOA+ に対応した高度な監査証跡機能を備えたタッチパネルを発紘電機の協力のもと開発した。
「例えば、作業ごとに強制的に作業記録が残されていくため、帰属性、同時性、完全性が確実に担保される。他の汎用タッチパネルにはない機能として、パラメータの変更に際してその理由を入力することができ、変更した作業者とその上長による二段階認証で信頼性を高めている。zenon の専用HMI の搭載が難しい製造機器にも容易に搭載可能で、ライン全体をより網羅性高く、同一プラットフォームで監査証跡を残すことができるので、製薬企業からも高く評価されている」(武内氏)。

監査証跡の帰属性を保証するのが、生体認証ウェアラブルデバイスである。
このデバイスは、スマートウォッチのように手首に装着し、タッチパネルのセンサーにかざすことで、各機器へのユーザーログインや承認を非接触で行うことができる。作業前に15 秒ほどの指紋認証と心電図の計測で個人識別が行われ、脱着すれば認証が解除されるため、他人が使用することは不可能であり、確実な帰属性が保証される。非接触型であるためクリーンスーツや手袋、ゴーグルなどを着用したクリーンルームでも使用可能である。ID・パスワードはなりすましのリスクが高いため、欧米ではすでに生体認証への移行が進んでおり、日本でも近い将来に導入する企業が増えることが予測される。
■早期に電子システムを導入しなければ、ますます品質コストは高まる
人手をかけたDI 対応は非現実的である。効率化と品質保証は矛盾するようであるが、FIDIUS はそれを可能にする。自動で作業ログを残し、同一形式で同一場所にデータを保管することで、追加データの記録や整理といった作業が削減される。新規導入機器や変更時にも一元管理によってデータを一貫して取り扱うことができ、ユーザーに関しても一元管理をしているため、異動などによる入退所の際は一括で変更が可能で、その変更もログに残される。
さらに、生体認証ウェアラブルデバイスによるユーザー認証は大きなコスト削減にもなる。一般的にログインID・パスワードで認証を行っているが、ある調査によると製薬企業の製造作業者が各機器などへログインするために1 日当たり約100 分も費やしているという。生体認証ウェアラブルデバイスでは、これが6 分まで削減される。100分から6 分─。雲泥の差である。
医薬品製造に設備投資は欠かせない。FIDIUS を導入すれば、今後FIDIUS に対応した機器を既存のFIDIUS システムに接続するだけでDI 対応が可能となる。また、医薬品製造機器メーカーにとっても、あらゆる機器に対応するFIDIUS は福音である。DI 対応により、製薬企業は機器単体ではなく、ライン全体のDI 対応レベルを踏まえた機器導入が求められるようになった。製薬企業に導入を検討してもらう際、自社の製品がFIDIUS に対応していれば、購入メリットにもつながるだろう。
第一実業では、DI 対応ソリューションパッケージとして、国内の医薬品製造機器メーカーのアライアンス化を目指す。海外ではこのような動きが活発で、外資系製薬企業を中心にこうした活動への期待が高まっているという。すでに複数の医薬品製造機器メーカーやサプライヤーもアライアンスに参加しており、今後も参画企業を増やしていきたいとしている。
査察時に厳しい指摘を経験した企業も多いだろう。今後、DI 対応に対する規制が厳しくなることはあっても、緩まることはない。「次世代型エンジニアリング商社」を目指す第一実業では、製造現場にシステムを導入し、確実なユーザーセキュリティで保証された監査証跡を、統一されたプラットフォームで医薬品を製造し、安心安全な薬を患者に届けるという使命を、FIDIUS を通じて支援したいとしている。
●その他の製品についてはこちらをご覧ください。
■お問い合わせ
第一実業株式会社 ヘルスケア事業本部
〒101-8222 東京都千代田区神田駿河台4-6 御茶ノ水ソラシティ17F
E-mail:healthcare@djk.co.jp
URL:https://www.djk.co.jp








