━AD━
バイオ医薬品開発・上市の最速化戦略を提案
-1000社超の要望に応えた経験・知見が武器
パセオン(Patheon by Thermo Fisher Scientific)

2020年12月に開催されたファームテクジャパンWEBセミナーで、パセオンはバイオ医薬品製造施設の拡張プランとバイオ医薬品開発の最適化技術などに関して講演を行い、大きな注目を集めた。
講演者の一人である同社アジアパシフィック事業開発ディレクターの谷元浩二氏は、「品質はCDMOにとって特に重要なクライテリア。当社ではバイオ医薬品の豊富な受託経験をベースに、さらなる高品質のワンストップサービスをお客様にお届けしていく」と自信を示す。
■品質を根底に据えたグローバルCDMO
近年、医薬品を取り巻く環境はバイオ医薬品を筆頭に新しいモダリティの登場により激変している。それは米国FDAのAccelerated Approval(迅速承認)、Fast Track(ファスト・トラック)、Breakthrough Therapy(ブレイクスルー・セラピー)またはPriority Review (優先審査)の指定を受ける医薬品の割合が2015年の45%から2019年には60%へと増加していることからも明らかであろう。このように新薬などの開発加速が進む中で、製造をボトルネックにしてはならない。そこで重要になるのが品質、キャパシティ、ニーズに応える製造能力を兼ね備えるCDMOの存在だ。
そのような背景のもと、サーモフィッシャーサイエンティフィック、ファーマサービシスではバイオ医薬品のCDMO機能を近年、さらに拡充しており、製薬業界生き残りの大きなカギであるバイオ医薬品開発のスピードアップに貢献するソリューションを次々と発表している。
同社では現在、取引企業数は1000社を超える。1日当たり100万人に治験薬を含めた医薬品を患者に届けており、5年後にはこの数を2倍の200万人にすることを目指す。同社のファーマサービシスを担うパセオン(Patheon)の谷元氏はこの目標の実現にむけて「品質はCDMOにとって特に重要なクライテリアであるととらえている。製造現場では常に不良ゼロの目標を掲げて活動しており、当社にはその品質を根底に3つの中期戦略を掲げている。まず“Start Here, Stay Here”、つまり、高い品質のサービスを届けてお客様から信頼を得ることで、初期開発から後期開発、上市までお手伝いさせていただきたいと考えている。次に“integrated offering(統合したサービス)”も提案している。原薬から製剤、包装や配送業務までワンストップサービスとして活用していただくことを目指している。そして、それを実現させるためにさまざまな点で“デジタル化”を取り入れていくことが必要と考えている。すでに各種分析業務、開発、生産およびサプライチェーンマネジメントにおいてデジタル化によって効率を上げている。近年ではバーチャルシステムを活用した工場見学、当局の監査やお客様の査察を実現している」と3本柱の戦略を示す。
■“Start Here, Stay Here”
-多様なニーズに応える体制整備を進める
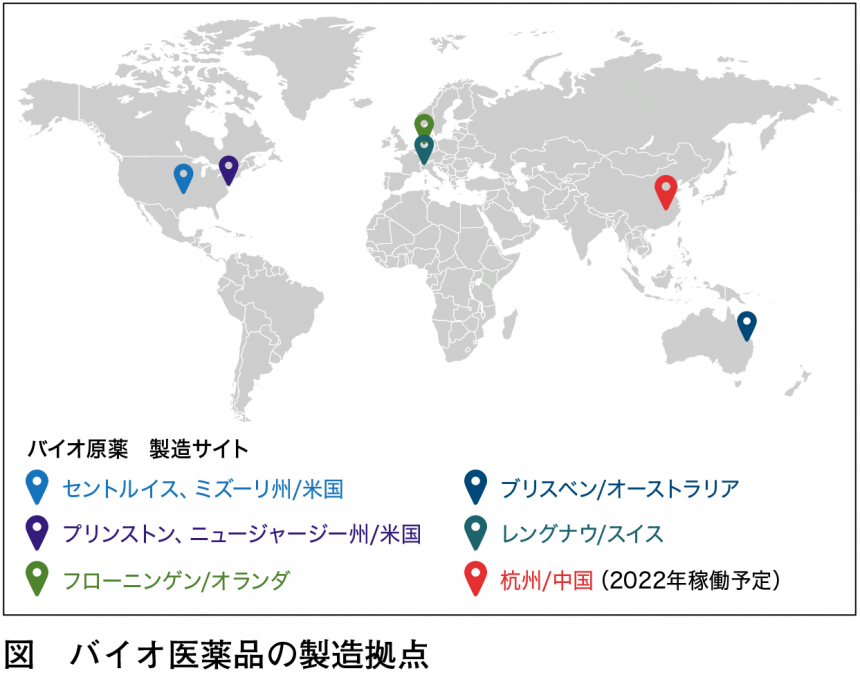
同社は2017年のパセオン買収をはじめとして、時勢に合わせてCDMO事業に投資してきた。その中でもとくにバイオ医薬品関連は優先し、注力している。アジア圏に新規の工場建設も進めていることも見逃せない(図)。2022年には中国・杭州に同社として初となるバイオ原薬および注射剤の充填が製造可能な工場を稼働させる。また同時期にシンガポールにもワクチン製造拠点を新設予定である。これまでアジアに受託製造設備を擁していなかった同社が、グローバルCDMOとして新しい需要に応える姿勢がうかがえる。このほかにも、既存施設のさまざまな拡張計画を遂行中で、2022から2023年にかけて現在の2倍ほどのキャパシティになる見込みである。
キャパシティ増強だけではなく、多様な技術導入に着手している点も注目したい。同社は米国セントルイスに、業界初となる5000Lシングルユース培養リアクターを導入する。これまでCDMOでは初期開発の小規模培養と大規模培養槽のいずれかに特化することが多かった。しかし、近年では稀少疾患用治療薬やバイオシミラーなどの開発が進んだことから、2000〜10000Lスケールの製造戦略が求められており、新たな設備が稼働することで今後トレンドとなるボリュームでのスケールにも応えられることになる。
豊富な経験から蓄積された開発力に加え、設備面でも多様なニーズに対応する生産体制が整うことになる。
■“エンドツーエンド”と“フレキシビリティ”の両立
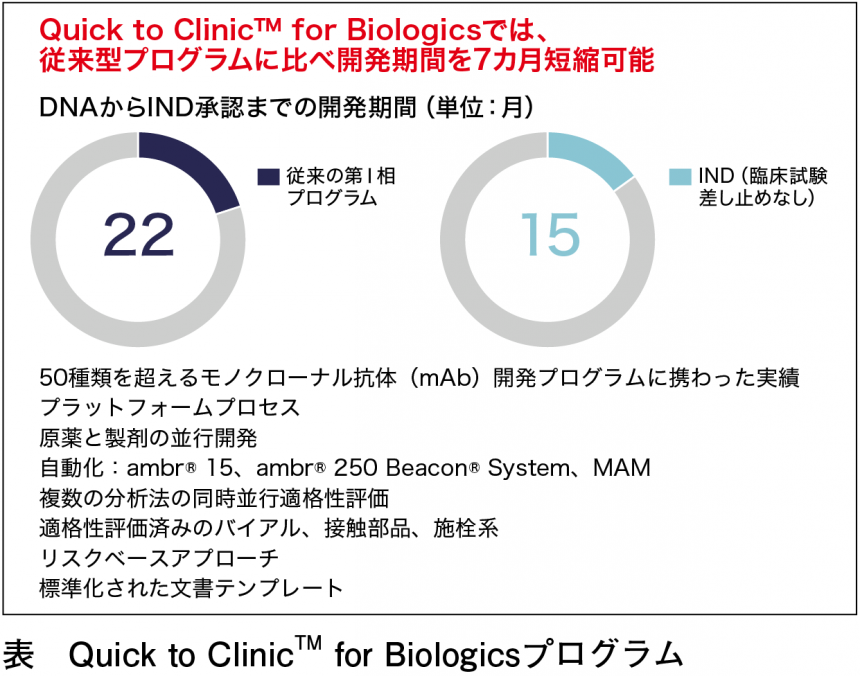
同社が提供するサービスのキーワードの1つに“エンドツーエンド”が挙げられる。迅速な開発には一気通貫したサービスが有効である。同社のQuick to ClinicTM for Biologicsはバイオ医薬品開発においてFIH試験への迅速移行を支援するプログラムである(表)。同社のプラットフォーム技術で最適化した本プログラムは、開発期間を従来型のプログラムよりも7カ月短縮に成功している。本プログラムは、原薬や製剤の初期開発、プロセス開発、分析法の開発、治験薬の製造ののち、治験薬製造後の包装、ラベリング、コールドチェーンを含めた治験施設への配送までワンストップサービスとして提供可能である。
谷元氏は「治験施設まで責任をもって届けるところが大きな特徴。これは他社にはない」と業界唯一のエンドツーエンドのCDMOサービスに自信を見せる。もちろん、治験後の後期開発におけるプロセスキャラクタリゼーションやバリデーション、上市後の商業生産や包装まで一貫したサービスも受けることができる。
“フレキシビリティ”も重要なキーワードとなっている。「開発の際にはお客様の技術を適用して当社プラットフォームと組み合わせることもできる」と柔軟性のある開発も可能であることを強調する。
同社では2019年には6300件の治験プロジェクトをサポートした実績を誇るが、これは同社の「迅速開発プログラム+顧客とともにプロジェクトを進める姿勢」が信頼を得ていることの表れといえるだろう。
■30年以上No Warning Letterの実績と進化する技術
高品質でハイレベルなサービスを提供するうえでデジタル化は最重要テーマの1つとなっている。同社の代表的な取り組みとして、VRやAR技術の活用がある。とくにバーチャル工場見学、バーチャル査察はほぼ全施設で導入されており、講演時点で、当局査察を12件、委託企業による監査は125件が無事に完了している。
「現場のオペレーターがホロレンズのヘッドセットを装着し、実際に製造現場を歩きながら、リアルタイムで画面を通じて施設を見学できる。お客様や査察者の要望に応じて360度視界を動かして説明することが可能で、質問を打ち込んでもらえれば、ホロレンズに表示され、オペレーターからその場で回答される仕組みになっている。新型コロナウイルスの感染拡大により、物理的に施設に訪問することが困難になったなかで、バーチャルでのソリューションは高い評価をいただいている」(谷元氏)。
30年以上のGMP製造の歴史で米国FDAからWarning Letter(警告書)を一度も受けず、直近10年の新薬承認件数が業界2位と比べて2倍という圧倒的な実績に裏打ちされた高品質なサービスを提供し続けている同社。進化を続けるさまざまなサービスは、医薬品の迅速な上市の大きな助けになるだろう。
■その他の製品についてはこちらをご覧ください。
【お問い合わせ】
パセオン株式会社
〒103-0023 東京都中央区日本橋本町 3-3-6 ワカ末ビル 7F
TEL:03-6202-7666
E-Mail:wakako.kawada@thermofisher.com
ウェブサイトはこちら








