─AD企画━
製品ライフサイクルの概念にもとづいた開発と
バリデーションの重要性
サクラエスアイ

ホールディング株式会社
代表取締役会長
松本 謙一 氏
例年開催している滅菌バリデーションセミナーが2019年9月20日に開催され、滅菌の基礎、滅菌バリデーションの基礎、滅菌装置の設計/検証/運用の基礎のほか、外部講師を招き特別講演を行った。
開会に先立ち挨拶したサクラグローバルホールディング株式会社会長の松本謙一氏は、近年の海外からもたらされる感染症に対し、エビデンスを根拠に対策することへの課題や、単回使用医療機器の再利用に対する安全・安心な滅菌・洗浄の信頼性などの話題に触れ、「科学的データにもとづいた感染対策、滅菌バリデーションの重要性を再認識した」と話した。
■製品ライフサイクルには「設備/ 装置等」も含む
恒常的な製品適格性の確保は「開発」段階から重要

学術顧問 髙橋 治 氏
「滅菌バリデーションの概念」について、同社顧問の髙橋治氏が講演。滅菌バリデーションと製品ライフサイクル、湿熱・EO 滅菌のバリデーション規格の概要を主なテーマに挙げ、さまざまなガイドラインや規格基準文書などの記載をもとに、用語の定義や具体的に意味する内容を整理した。
髙橋氏は冒頭で、「バリデーションは、恒常的な製品適格性の確保を目的とし、その目的を達成するための手段は、製品ライフサイクルを通じて集積した知識や情報を活用することである。製品ライフサイクルとは、医薬品開発、技術移転、商業生産及び製品の終結の全過程を指す」と、通知やGMP 事例集などを示した。
そして、医薬品品質システムに関するガイドラインやFDA プロセスバリデーション・ガイダンスを引用して、製品ライフサイクルが「開発」、「検証」、「運用」の3ステップで構成されるとし、「設備・装置なども製品ライフサイクルの概念の適用が必要であり、製品ライフサイクルを通した検証や運用もふまえ、適切な品質、設計をもった開発に重きをおくべき」と話した。
さらに、バリデーション用語について髙橋氏は、製品ライフサイクルの概念に基づく恒常的な製品確保としての広義の意と、IQ・OQ・PQ の検証を指す狭義の意があり、ガイドラインなどを読む際は注意するよう促した。
その後、滅菌バリデーションに置き換えて解説し、内容を掘り下げた。滅菌装置・製品・プロセスの品質は「開発」で決まるとし、Quality by Design(QbD)の重要性の理解と、IQ・OQ・PQ は「狭義のバリデーション」または「検証」であること、日常的管理・継続的検証・変更管理による「運用」の重要性を説いた(図1)。
滅菌バリデーションに関するISO 規格および対応するJIS 規格や、その滅菌関連ISO 規格と国内規制の関係などを図示して、滅菌関連ISO 規格に基づいて調和済みであると話した。湿熱滅菌、EO 滅菌について章ごとに詳説した後、講演の最後に「製品ライフサイクルの概念は医薬品製造で明示されているが、医療機器製造でも同様の考え方である」とまとめた。

■MDR でも、製品ライフサイクルに焦点 包装のバリデーションが明確に

スパンプロダクツ株式会社
池田 一朗 氏
特別講演に登壇した旭・デュポン フラッシュスパンプロダクツ株式会社の池田一朗氏は、「医療機器包装規格の最新情報について ~ MDR との関連性とISO 11607 の2019 改訂」と題して講演した。
はじめに池田氏は、欧州(EU)にはまず3 つの医療機器に関する指令、「AIMDD」(能動埋め込み型医療機器指令)、「MDD」(医療機器指令)、「IVDD」(体外診断医療機器について)があることを示した。そして、これらはそれぞれの移行期間を経て2 つの規則、「MDR」(医療機器に関するEU 規則)、「IVDR」(体外診断医療機器に関するEU 規則)が適用されると説明した(図2)。
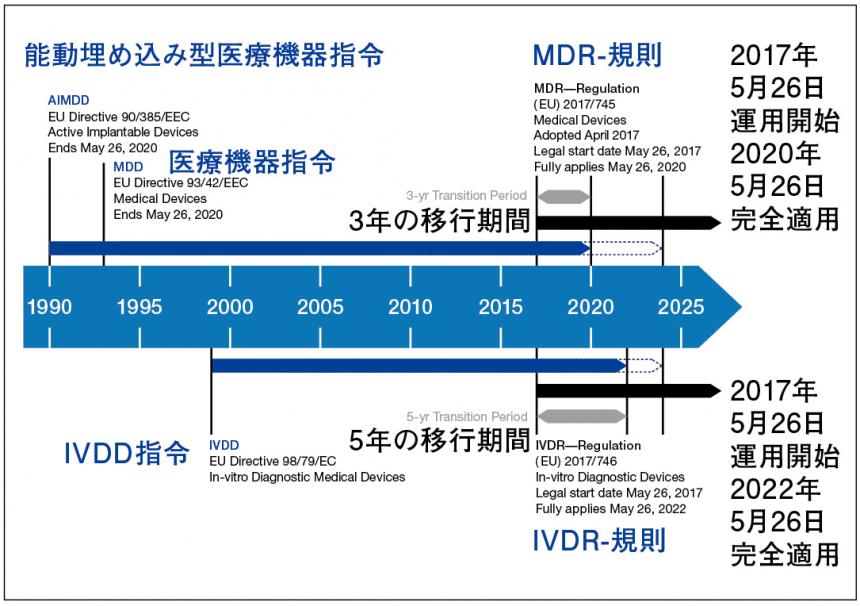
MDD およびAIMDD に代わるMDR は、3 年間の移行期間が設けられており、この移行期間中に技術文書などを改訂し、新しい要求事項に対応しなければならない。池田氏は、MDR では従来よりも踏み込んだ精査が求められているとし、一般的な安全性および性能要求事項(GSPR)が示されているMDR 付属書1の医療用滅菌包装に関する事項について、MDD と比較しながら主な変更点を要約した(図3)。
例えば、GSPR 第Ⅱ章 設計と製造に関する要求事項、11. 感染と微生物汚染の項では、「取り扱いが容易で安全であること」、「機器またはその内容物の微生物汚染を防止する」などの文言が追加されたことを示し、「設計は、容易で安全な取り扱いを可能にし、微生物汚染を最小限に抑えなければならないということは、具体的に“包装”と記載されてはいないが、包装が果たす役割は大きい。包装にインパクトのある新しい要求事項である」と池田氏。
ほかにも、「滅菌状態で出荷される機器は、使用時点で開封されるまで無菌状態を維持しなければならない。つまり、使用時点まで無菌性を担保し、包装の完全性が最終的なユーザーに明らかに示されなければならない」こと、また滅菌包装ラベリングの新しい要求事項として、「滅菌包装が破損した場合、または意図せずに使用前に開封された場合に何をすべきかについての指示がわかるようにしなければならない」ことなどを挙げ、包装のバリデーションが明確な要求事項となり、またデバイスのライフサイクルに焦点が当てられ、包装の設計と全ライフタイム(廃棄まで)が含まれていると説明した。

こうしたMDR の新しい要求事項に合わせてISO11607も改訂された。ISO 11607-1:2019 では、無菌提供のユーザビリティ評価や、包装システムの性能および安定性、包装システムのバリデーションおよび変更、無菌提供直前の検査などが新規項目として追加されていることを示し、これらの項目について解説がなされた。
そのなかで、「6.1.8 使用時点で開封される包装システムが2 層以上の包装で層が構成されている場合、無菌バリアシステムに、そのことがわかる表示がつけられていなければならない」という記載に触れ、池田氏は「MDR では、滅菌包装がそのように認識されることを可能にする表示が要求されている。必ずしもグラフィックシンボルで表示することとは書かれていないが、グラフィックシンボルでの表示が最善の方法であることから、現在、さまざまなシンボルデザインが検討されている。承認されればそのシンボルはISO15223-1 に記載される予定である」と紹介した。
■お問い合わせ
サクラエスアイ株式会社
〒103-0023 東京都中央区日本橋本町4-5-14 入江ビル
TEL:03-3231-1612
E-mail:info@sakurasi.com
URL:http://www.sakurasi.com








