━AD企画━
バイオ医薬品の効果的な開発戦略
-合理的な技術導入
ロンザジャパン

バイオ医薬品のライフサイクルマネジメント
─選択肢の広さが成功の鍵を握る━
7月5日、都内の東京ビッグサイトで開催されたインターフェックス Week 2019の併催セミナーで、Lonza社のJeetendra Vaghjiani氏(Director, Commercial Development)が、「バイオ医薬品のライフサイクルマネジメント戦略」をテーマに講演した。
■ライフサイクルマネジメントとは何か?
バイオ医薬品市場が成長を続ける中で各社の競争環境も厳しくなり、製品開発や製造プロセスも複雑化している現在は、プロジェクトの早期から上市、その後の市販も念頭に置いた戦略を練ることが成功の鍵になっている。これは“ライフサイクルマネジメント”が重要と換言できるが、Vaghjiani氏は冒頭で「われわれは“ライフサイクルマネジメント”を、得られる価値を最大化し、開発・製造のタイムフレームを最小化する能力だと考える」と語った。つまり、より迅速に製品を開発し、後の適切な製造戦略によって合理的な製造コストで市場に送り出すための手法だといえる。
「例えば、ファストトラック等迅速審査の対象になれば、最初の適応で早期に承認を取得し、適応追加によって製造スケールを拡大していく方法もある。典型的な例としては、最初の適応で2,000ℓスケールで発売し、その後適応追加で需要が拡大した際に6,000ℓ、10,000ℓとスケールアップするという戦略がある」と、Vaghjiani氏は一例を示した。
■開発戦略はコストにも影響を及ぼす
効果的な開発戦略はコスト低減にもつながる。Vaghjiani氏は、細胞株開発から工程開発、分析法開発、技術移転、スケールアップまでの各段階での考慮事項を細かに解説し、タイムフレームとコストの考え方を示した。
細胞株開発については、「特にFDAはクローン性の評価を重視している。十分にクローン性が証明されていなければ、繰り返しの作業を求められる可能性があり、追加費用発生や開発遅延を招きかねない。毒性研究を繰り返し、臨床データを取り直す必要に迫られれば、最大で2年程度開発が遅れ、合計70〜1,000万ドルの潜在的な追加コストを生むという例もある。これは最初からクローン性の正しい細胞株を作製していれば避けられるコストだ」と説明した。
さらに、「細胞株の安定性試験は、最初の段階で必須というわけではないが、第Ⅱ相、第Ⅲ相では必要。最初に得た細胞株の安定性が証明されていない場合、生産性がやや低い細胞株を選択する可能性もあるため、初期で安定性試験を省略すれば後期段階でのリスクにもなりうる」とし、品質を中心に据えつつ、リスクと時間、コストを総合的に考える必要性を指摘した。
■早期から“正しい手法”で行うこと
分析法や工程開発でも、早期から“正しい手法”で取り組むことが重要だ。通常、一から工程開発に取り掛かると、さまざまな検討因子があるため複雑性が増してしまうが、Lonza社は独自のプラットフォームアプローチをもとに、そこから最適化することによって負担を低減しているという。
「分析法開発や処方設計において、当社ではプラットフォーム法を採用しており、初期評価等の業務負荷を低減できる。処方設計では、多くの実績を積み重ねているプラットフォームアプローチで検討過程をシンプルにし、全体の開発タイムフレームを短縮するよう努めている。各プロダクトにこのアプローチを応用することで、開発途中での変更への対応や、最終処方を最適化することができる」(Vaghjiani氏)。
上流、下流の工程開発でも、Lonza社はプラットフォームを用いることで効率化を実現している。「培地および供給物は宿主の細胞株用にすでに十分な試行を重ねた方法で最適化されており、顧客の業務量を低減できる」とVaghjiani氏は語る。Lonza社のプラットフォームは、多くの顧客や細胞株とともに蓄積した豊富なデータに裏打ちされた信頼性が強みでもある。承認申請の際もいくつかの試験実施を省略できる可能性もあり、薬事的観点でもメリットは大きい。
■選択肢の広さがビジネスの可能性を広げる
開発迅速化に加え、上市後は市場ニーズに応じて製造量を最適化することが必要になる。Vaghjiani氏は、「ディスポーザブル製品のコスト、ステンレス設備の固定費、設備立ち上げ費用等を勘案し、最適なコストバランスを探る。初期はスモールスケールで製造しても、製造量増加によってミドル・ラージスケールに移行することでコストを合理化できる」と製造戦略構築の考え方を述べた。
さらに「スモールスケールでの製造では多くのバッチを回すため、都度記録が必要となり逸脱発生の可能性も高まる。一定量を超えると、コストのみならず逸脱防止の観点からも、より大きなスケールに移行したほうが好ましい」と付け加えた。
市場環境によって製造量は変動するため、需要にあわせた製造戦略が必要になる。ここで重要なのはあらゆるケースに対応可能な選択肢を持つことであろう。Lonza社は世界中にもつ拠点で多様な製造スケールに対応しているが、こうした選択肢の広さは戦略の自由度を高め、プロジェクトを成功に導く可能性を高めるといえるだろう。
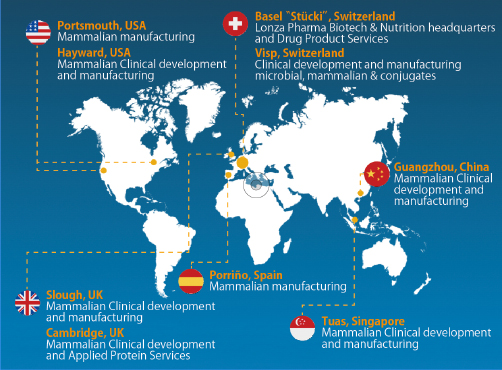
*細胞治療・遺伝子治療サイトをのぞく
■1つのサイトで実現する“ライフサイクルマネジメント”
Vaghjiani氏は講演の最後に、Lonza社の新たな取り組みとして、「スイスのVisp(フィスプ)にバイオパークを建設している。マルチスケールのGMP対応施設を導入し、細胞株や工程開発も行えるこのサイトで、遺伝子から原薬・製剤の製造まで対応するIbexTM Solutionというサービスを提供する予定だ」と紹介した。
IbexTM Solutionは、1,000ℓ、2,000ℓを使用する候補配列の決定後からINDまでを対象にIbexTM Design、中期から後期の開発等を対象にしたIbexTM Develop。主に6,000ℓ以上のミドル・ラージスケールで対応する商用生産のIbexTM Dedicateの3種類からなる。すべ てのステップを網羅し、製品価値最大化とタイムフレーム最小化の“ライフサイクルマネジメント”を、1つのサイトでシームレスに提供するものだといえよう。なお、IbexTMの提供開始は2020年から順次予定しているという。
このようにセミナーでは、“ライフサイクルマネジメント”の重要性が再認識、プロジェクト成功への考察が共有された。

【お問い合わせ】
ロンザジャパン株式会社 受託製造開発事業部
〒104-6591 東京都中央区明石町8-1 聖路加タワー39階
TEL:03-6264-0600(代表)
E-mail:pharma-biotech-jp@lonza.com
URL:https://pharma.lonza.com









