━AD━
製薬企業向け「製造記録書の発行管理システム」
~監査業務厳格化に伴った、製造記録書の発行管理電子化ニーズへの対応~
ユニオンシンク

ユニオンシンク(本社:大阪市中央区)は、ワークフロー、見積管理、業務自動化などのシステム「デザイナーシリーズ」のラインアップの1つとして、変更管理やCAPA(是正・予防措置)管理業務を多角的にサポートする品質管理システム【業務デザイナー for GxP】を開発。製薬企業を中心にすでに90 社を超える採用実績を誇る。2019 年4 月には製品名を【品質デザイナー for GxP】と改め、装いを新たに品質管理業務を支えるシステムとして販売している。加えて顧客からのさらなる要望に応えるため、“製造記録の発行管理システム”をオプションとして2019 年7月にリリースすることとなった。本稿では、常に製薬企業のニーズに応え続ける同社の東京本社取締役の天野敏史氏と北陸エリア担当の川野剛志氏に開発経緯などを聞いた。
■「紙」による管理から「コンピュータシステム化」へ
製薬企業を取り巻く規制環境は近年、めまぐるしく変化している。厚生労働省から2012 年10 月21 日付で「医薬品・医薬部外品製造販売業者等におけるコンピュータ化システム適正管理ガイドライン」が発出され、CSV 対応が規制要件となったほか、2014 年には日本の規制当局がPIC/S に加盟したことから、PIC/SGMP への対応が課せられた。2019 年は改正GMP 省令の発出が予定されており、この改正GMP 省令にはデータインテグリティ、文書および記録の完全性の確保に関する事項が明示される予定である。
「データインテグリティの確保は、GMP 活動の基本で決して新しい規制要件ではありません。手書き記録、電子記録ともにデータの信頼性に求められる要求レベルは同じなので、医薬品の製造工程においては厳しい管理体制構築が求められてきています」と、データインテグリティ確保体制の見直しは喫緊の課題だと天野氏は言う。
そのような規制強化を受けて、QA/QC 部門の作業量が増加していく中、人員の確保・教育が一層困難になってきている。そこで、多くの企業は作業の効率化、高水準の品質を担保するため、従来の「紙」による管理からコンピュータシステム化による管理に移行してきている。また、原本性の保証や改ざん防止に関するデータインテグリティ不備が、規制当局から指摘される件数が増加傾向にある。
「規制当局以外に、外資系企業の監査において、QA主導管理による『発行(印刷)時の紙に対する“原本性”の保証』や『記録書の改ざん防止』が求められることが増えてきています。そのため、システムを活用し、QA 業務の効率をより高めていきたいというニーズもますます高まってきています」(天野氏)。
■ワークフロー連携で、スムーズな文書管理体制を構築
「そのような状況が進む中、今から6 年前に弊社に多品種小ロット製造が中心の製薬企業様から『紙で大量の帳票を作成・管理するのは大変なのでコンピュータ化したいが、大規模で高額システムの導入は難しいのでなんとかして欲しい』というご要望をいただいたことが、システム開発のきっかけになりました。おかげさまで、利便性が口コミで広がり、PIC/S 加盟を機に導入依頼が増えています」と、川野氏。自身が担当する北陸エリアの製薬企業からのさまざまな要望の中の1 つであった、膨大な作業を伴う製造記録書の発行管理の効率化に注目し、今回の製造記録書の自動管理システムの開発がスタート。試行錯誤の末、製薬企業が求めるシステム実現にこぎつけた。
【品質デザイナー for GxP】は、変更管理や逸脱管理、CAPA 管理など多岐にわたる業務申請から検討・実施・完了までの進捗を一貫管理し、スムーズな業務運用をワークフローで構築できる。また、文書管理機能と連動することで、標準書やSOP など最新版の管理や発行日・履歴管理から原本保管までを一気通貫で実現可能なので、改ざん防止や監査証跡を求める21CFR Part 11、ER/ES に対応し、CSV 準拠のシステムとなっている。
「本システムは業務を見える化するので、業務規程やマニュアル規定された帳票と業務フローをシステム上に記載でき、業務の継ぎ目を自動化することで効率化を図ることができます。たとえば、発生した逸脱の顛末がどうなったのか、CAPA の発生源と顛末を即座に確認し、出荷製品に関わる逸脱・変更状況も一目でわかります。対応期限が迫ると自動アラートが出されるので対応忘れも回避できます」(川野氏)。
■製造記録書の煩雑な管理が劇的に改善へ
前述したように、医薬品の品質保証体制をめぐる規制強化に対応するため、文書管理のシステム化への要望が高かったが、①製品ごとの多様な記録書様式の電子化とその管理、②電子化後の監査証跡をはじめとしたCSV 対応が必要、などの課題があった。
「現状の品質管理業務では、発行された製造記録書1枚ごとに担当者が穴抜き機で穴をあけたり、手書きサインを記載するなど、物理的な対応を実施しているため、大きな負荷が発生していました(図1)。
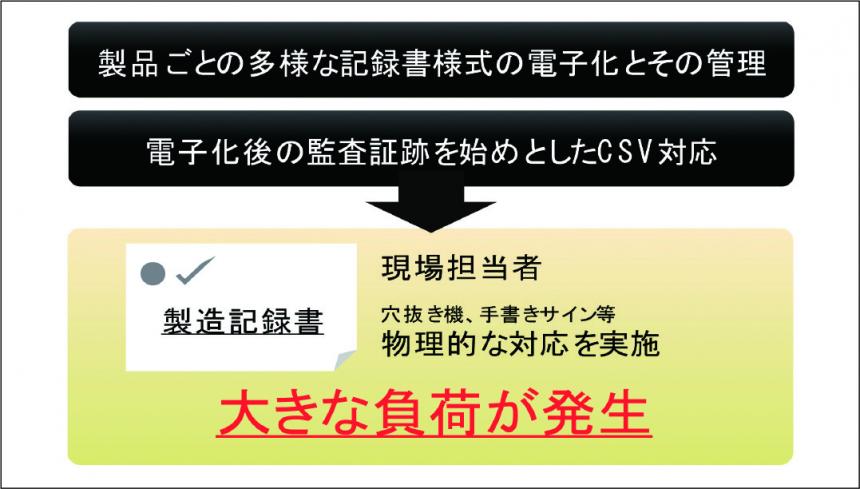
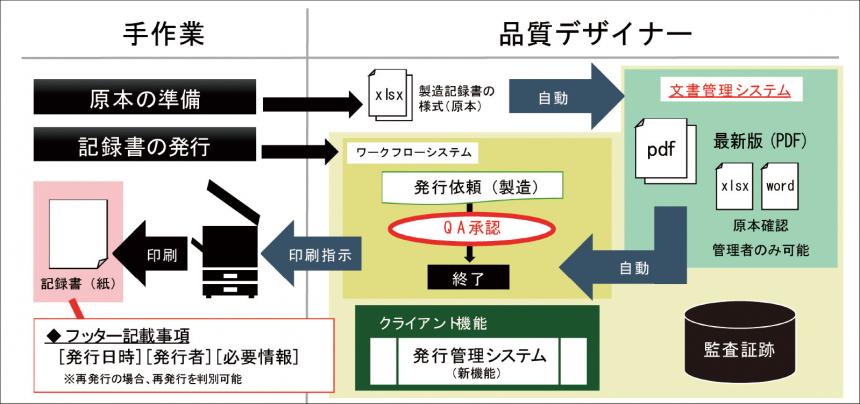
そこで、改ざん防止目的を意識したシステム化に取り組み、製造記録書の印刷時は“依頼内容”を追加(転記)し、手動作成を防止するようにしました。また、発行依頼から印刷までの作業をワークフローで管理・運用することで、監査証跡として残すことができ、QA 主導管理を実現させました。帳票類は、現状のWORD やEXCLのレイアウトのまま電子化することも可能です(図2)」(川野氏)。
今回、開発された製造記録書発行システムは【品質デザイナー for GxP】の文書管理システムを活用することで、最新版/履歴の管理を行うことができ、依頼から印刷までを人手を介さずにシステム管理ができるほか、印刷時には依頼内容が転記され、手動作成を防止する。また、コピー機の機能を活用することで、印刷後の不正コピーもできないなどの改ざん防止も実現可能である。
■現状に満足することなく、ユーザーに寄り添ったシステム開発
「弊社が開発した品質管理システム【品質デザイナーfor GxP】を活用していただければ、業務改善を強力にバックアップすることができます。今回開発した製造記録書発行システムは、製薬企業の品質管理業務の効率化はもちろんのこと、正確性の向上にも寄与します。弊社はユーザー様のメリットに寄り添って、システム開発をしてきました。システム会社のエゴを押し付けるのではなく、常にGxP 領域の勉強を続けながら、ユーザー様にとって使いやすいシステムを今後も追求していきます。本システムは、7 月開催のインターフェックスジャパンで展示するので、是非、立ち寄っていただき、現場での悩みなどを相談ください」と、天野氏は今後もさらなるシステム開発に意欲をみせる。
【お問い合わせ】
株式会社ユニオンシンク
〒542-0081 大阪市中央区南船場4-11-28
東京 TEL:03-5425-7211
大阪 TEL:06-6258-1100
URL:https://www.utc-net.co.jp/








