─AD企画━
滅菌バリデーションセミナー 2018東京
盛況に開催
サクラエスアイ

ホールディング株式会社
代表取締役会長 松本 謙一 氏
例年開催している同セミナーが10月19日に開催され、滅菌の基礎、滅菌バリデーション の基礎、滅菌装置の設計/検証/運用の基 礎の他、外部講師を招き特別講演を行った。
サクラグローバルホールディング株式会社代表取締役会長の松本謙一氏は開催にあたり「基礎から深く掘り下げたところまで、参加者の皆様とともに情報の共有化を図っていきたい」と挨拶。
当初、定員100名であったところ約170名の参加者が集まり、席数を増やしての盛況な会となった。
滅菌バリデーションは「開発」「検証」「運用」の視点から理解

学術顧問 髙橋 治 氏
同社顧問の髙橋治氏は、「滅菌バリデーション基礎」と題し、ISO/JIS 規格に基づく滅菌バリデーションの概 念、製品適格性と滅菌条件の設定などについて講演した。
はじめに、滅菌関連のISO 規格と、そのほかの国内規制である「第十七改正日本薬局方」や「無菌操作法による無菌医薬品の製造に関する指針」(無菌操作法指針)などとの関係性が示され、髙橋氏は「滅菌関連ISO 規格が国内の各規制に大きな影響を与える基本概念である」と話し、その理解の重要性を強調した。
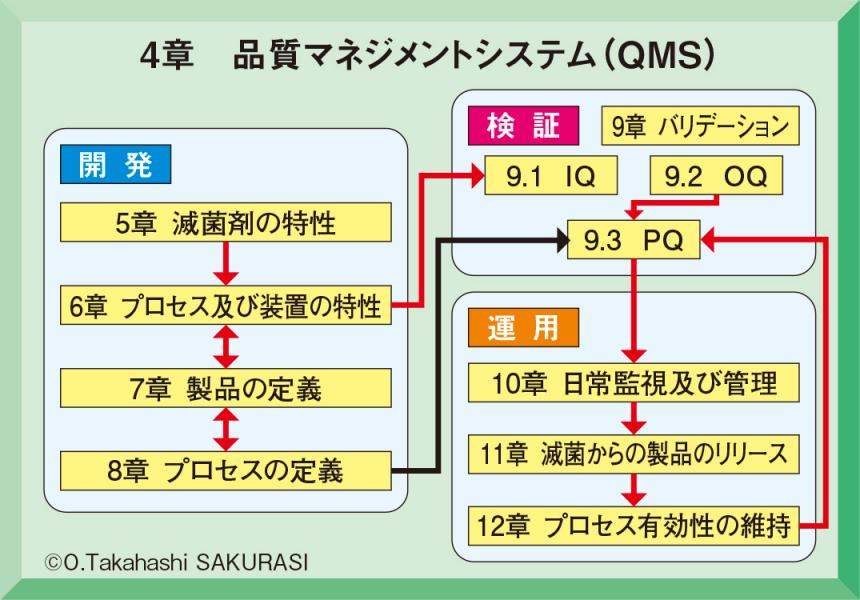
さらに、滅菌バリデーションISO/JIS 規格の章構成を示しながら、各章の位置づけを確認(図1)。滅菌バリデーションが、①滅菌装置の開発・製品の開発・プロセスの開発といった「開発」、② IQ/OQ/PQ といった「検証」、③滅菌装置、製品、プロセスの恒常的な有効性の維持や、日常的な監視および管理といった「運用」の3つの構成要素からなり、「開発」から「検証」を経て「運用」へと移る基本的なバリデーションの流れをわかりやすく解説した。
その後、「開発」、「検証」、「運用」の視点から、主にエチレンオキサイド(EO)ガス滅菌法および湿熱滅菌法に関するISO/JIS 規格の各章について比較しながら詳説した。
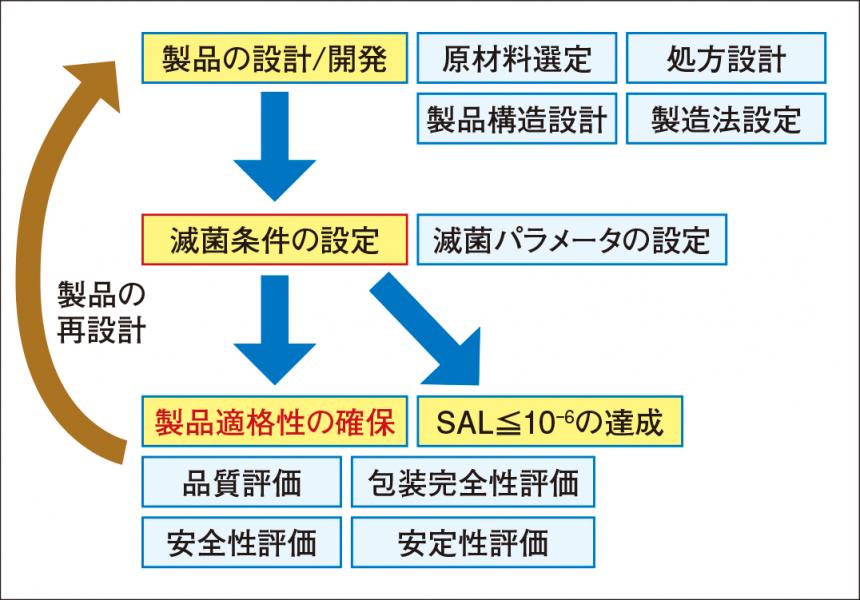
後半は、製品適格性の確保および滅菌条件の設定方法について講演。まず製品の設計/開発後、滅菌条件を設定し、品質評価や安定性評価などを含む「製品適格性の確保」および「SAL ≦ 10- 6 の達成」をめざす。これらが達成されない場合、製品の再設計へ戻って設定が繰り返されるといった流れが示された(図2)。
そして、滅菌条件の設定について、微生物学的方法のオーバーキル法(ハーフサイクル法、サイクル計算法)、バイオロジカルインジケーター(BI)/ バイオバーデン(BB)法、BB 法の手順と計算例を紹介。各設定法における製品適格性への影響、コスト、PCD のBIのD 値測定の必要性、BB 測定の頻度などを比較した。バイオバーデンの管理で、BB のD 値、菌数がBI より少ないにもかかわらず、SAL ≦ 10- 6 を達成しないこともある事例を示し、滅菌条件の設定で、① SAL≦ 10-6 の達成の条件として、BB の抵抗性および菌数がBI より低いという前提があること、つまりBBの菌数/ 抵抗性が判明していなければならないこと、を挙げた。
ほかにも、②適切な原材料を含む製品の清浄度の管理がなされていること、③ BB の管理頻度としては、BB 法> BI/BB 法>オーバーキル法の順であり、オーバーキル法でもBBの管理は必要であること、④製品適格性に応じた滅菌条件の設定において、滅菌プロセスのストレスに耐えない製品の場合、BB を減らす、滅菌条件の緩和などを検討すること、などとまとめた。
ISO 13408-6、PIC/S GMP Annex 1の改訂動向に注目

佐々木 次雄 氏
特別講演には、GMP Technical Advisor の佐々木次雄氏が「ISO 13408 シリーズの紹介-無菌操作法におけるアイソレータの除染-」をテーマに登壇。医薬品GMP を取り巻く規制環境、特に無菌医薬品製造の規制環境など、グローバルな規格化・規制の背景をふまえながら、ISO 13408 シリーズの「Part 6:Isolatorsystems」について紹介した。ISO 規格は、発行から5 年後に、規格の確認(Confi rm:現在の版を今後5年間維持する)、改訂(Revise/Amend:現在の版を改訂/修正する)、廃棄(Withdrawal:現在の版を廃棄する)などの必要性を、定期的な見直しとして、投票権のあるPositive Member(P メンバー)国によるSystematic Review 投票が行われるという。ISO13408-6 : 2005 は、2015 年に紀ノ岡正博氏(大阪大学)がコンビナーとして改訂作業を開始、作成された改訂案は2018 年9 月のロンドン会議をふまえて、11 月にweb 会議が開催され、DIS(国際規格案)投票準備に入るとして近況が発表された。
さらに佐々木氏は、PIC/S GMP Annex 1「Manufactureof Sterile Medicinal Products」(無菌医薬品の製造)の現行版/改訂案を紹介しながら、ISO 13408-6(2017改訂案)、FDA の無菌操作法ガイダンス(2004)、無菌操作法指針(2011)、ISPE(2005)、USP〈1116〉、第十七改正日本薬局方の参考情報「消毒法及び除染法」など、さまざまな規格基準書におけるアイソレータに関する記述に触れ、比較しながら解説した。PIC/SGMP Annex 1 については、2017 年12 月に改訂案が公開され、パブリックコメントが2018 年3 月に締め切られており、今後の改訂作業の動向も注目されている。
例えば、BI について、PIC/S GMP Annex 1 改訂案では「新しいバッチ/ロットのBI を使用する前に当該バッチ/ロットの品質について、生存可能な芽胞数および同一性を確認する必要がある」との記載があることを紹介し、BI の国際規格ISO 11138-1 のBI 使用者の要件には、芽胞数計測や菌種確認などの要件はないことなどから、「BI の芽胞数計測や菌種確認はPIC/S GMP Annex 1 要件になるだろう」と考えを述べた(図3)。
そして、BI を用いた除染確認については、「アイソレータでは105 ~ 106 CFU/carrier を用いて全数死滅で行ったほうが楽である。ただし105 ~ 106 CFU/carrier BI の全死滅は、6 log reduction と同等を意味するわけではない」と注意を促した。

同社では、こうしたセミナーが年に複数回開催されており、2019 年3 月は大阪、5 月には長野で開催予定である。なお、長野開催分は工場見学も含まれる。
■お問い合わせ
サクラエスアイ株式会社
〒103-0023 東京都中央区日本橋本町4-5-14 入江ビル
TEL:03-3231-1612
URL:http://www.sakurasi.com








