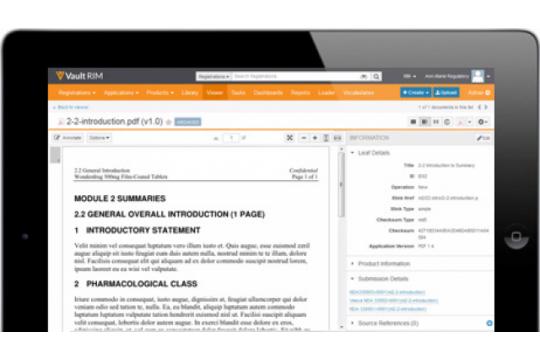
【Veeva Vault Submissions Archive】は、規制当局への完全な申請履歴をクラウド上で安全に保管。高性能のクラウドアーキテクチャにより、権限を付与されたユーザーは、公表された申請文書に迅速かつ容易にアクセスできます。
提携企業は、地域市場で再利用するために申請書類または申請事項をダウンロードでき、それらを当該地域の規制当局へアップロードすることも可能です。
■メリット■
●コンテンツのアクセス権限を管理
ルールベースの動的アクセス制御によって、文書のセキュリティを容易に管理
●規制当局への対応をスピードアップ
各地域オフィスや海外現地法人による申請書類も含め、過去の申請書類を容易に確認
●信頼できるグローバルな情報源
チームメンバーは、世界中のどこからでも許可された申請書類にアクセス可能
●規制への対応の統合
統合されたVault RIM Suiteにより、申請文書の作成をエンドツーエンドで合理化し、可視性と効率性を向上
■機能■
●ECTD形式及びそれ以外の形式でのインポートが可能
最終申請書類を記録や今後の参照用にインポートできます。XMLからデータを抽出して正規化することにより、データ精度向上
●統合型ビューアー
eCTD、NeeS、旧申請形式に対応したクラウドベースの統合型ビューアーにより、PCの規制対応ツール数を削減
●PDFリンクナビゲーション
PDFのハイパーリンクから申請書類内、申請書類間、アプリケーション間での文書閲覧が可能。別ツールやファイルのダウンロードが不要
●ライフサイクル全体を閲覧
文書のライフサイクル全体を、現在の状況、時系列、規制対応アクションごとに閲覧でき、各文書の変更履歴も見ることが可能
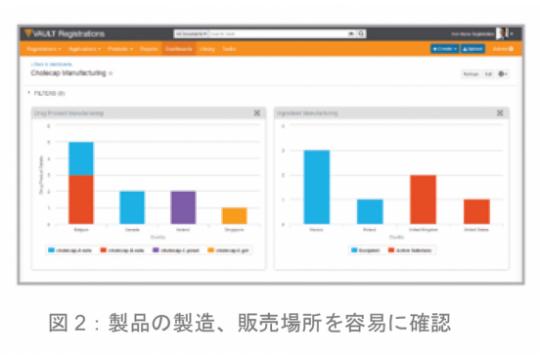
●ダッシュボードとレポート作成
製品、申請番号、地域、製造者など、必要な属性データを組み合わせた過去の申請レポートを容易に作成
●動的アクセス制御
基準に準拠したセキュリティポリシーを用いて、アクセス許可を動的に検閲し、各人が必要な情報以外は閲覧不可
●VAULT RIMデータモデル
一元的な規制データモデルにより、Vault RIMを構成するアプリケーションでの情報提供や共有ができ、規制対応タスク間のスムーズなデータ利用が可能
●規制当局への対応
規制当局とのやり取りと関連する申請文書とを自動的に関連付けて整理することにより、やり取りを適切な文脈で確認
●申請文書の一括エクスポート
製品の導出、共同研究、パブリッシングの外注などに必要な複数の申請文書を迅速にエクスポート
- WEB展示場 TOP
- Veeva Japan株式会社
- 規制当局への申請履歴に容易にアクセス【Veeva Vault Submissions Archive】
製品カタログ
関連資料
規制当局への申請履歴に容易にアクセス【Veeva Vault Submissions Archive】に関するお問い合わせ
この企業の他の出展商材
-

シンプル なマウス操作だけで、ビジネスソリューションをすばやく構築
臨床開発業務アプリ用プラットフォーム【Veeva Vault】
Veeva Japan株式会社 -
世界規模の整合性を実現し製品ポートフォリオの価値を最大化
薬事情報を一括管理【Veeva Vault RIM Suite】
Veeva Japan株式会社 -

製薬企業・CRO・サプライヤーなど全関係者を品質プロセスに組み込み、管理と可...
品質プロセスをグローバルに管理【Veeva Vault QMS】
Veeva Japan株式会社 -

企業のサイロ化を解消し、製品開発全体でエンドツーエンドのビジネスプロセスを推...
臨床開発・薬事・品質業務用の統合型アプリケーション【Veeva Vault Development Cloud】
Veeva Japan株式会社
企業情報
Veeva Japan株式会社
- 住所東京都渋谷区恵比寿1-19-19 恵比寿ビジネスタワー 5階
- TEL03-6721-9800 / FAX 03-3449-7800
- URLhttps://www.veeva.com/jp/